L'immunité sous toutes les coutures -
Évaluer l’immunité naturelle anti-Covid : sérologie, immunité cellulaire

Le sujet est passionnant, qui d’entre nous s’est vraiment immunisé contre SARS-CoV-2, qui peut donc en documenter une preuve de guérison? Quel crédit accorder aux sérologies réalisées en routine, sont elles fiables et nous montrent-elles une trace certaine de non contamination en cas de négativité? Peut-on bâtir une recommandation vaccinale sur ces seules données? Réponse nette et sans fioriture de notre spécialiste préférée, Hélène Banoun, qui a longtemps écrit dans nos colonnes sous son pseudonyme de Emma Kahn. Une politique sanitaire peut-elle se décider de manière parfaitement inadaptée au seul motif « qu’il faut bien faire quelque chose »… Bonne lecture.
Résumé |
Introduction
J’ai récemment montré que l’immunité naturelle à la Covid-19 (suite à une infection) était plus solide, plus durable et de meilleure qualité que l’immunité vaccinale (1) Les raisons en ont été exposées récemment par Sonigo et al (2). Avant l’introduction de la 3è dose, les autorités françaises conseillaient une seule dose de vaccin pour les personnes déjà immunisées naturellement (3). Pour l’instant la HAS ne prend pas position sur la nécessité d’une seconde dose chez les personnes ayant déjà été infectées par la Covid (4) Il est donc important d’évaluer les méthodes de mesure de l’immunité naturelle acquise après infection. Mais les personnes en bonne santé peuvent aussi éliminer un virus grâce à leur immunité innée non spécifique : on ne sait pas évaluer cette immunité et il se peut que chez ces personnes aucune trace de leur rencontre avec le virus ne soit facilement détectable. Dans la Covid, l’infection naturelle commence par les muqueuses du naso-pharynx qui sont un sanctuaire immunitaire (2). L’immunité innée à ce niveau peut suffire à éliminer les virus sans intervention importante de l’immunité adaptative et donc sans production importante d’anticorps spécifiques. De plus l’infection peut être combattue grâce à l’immunité croisée déjà acquise contre les coronavirus de rhume banal (5). L’immunité spécifique (adaptative) peut être évaluée par la mesure des anticorps circulants anti-SARS-CoV-2 et par la mesure de la mémoire cellulaire immune.
Rappel sur Immunité innée et immunité acquise
1- Immunité innée
Une revue récente expose l’immunité innée face aux infections virales (6).

Ricci D et al., 2021, https://www.mdpi.com/1422-0067/22/13/7017 , Innate Immune Response to SARS-CoV-2 Infection: From Cells to Soluble Mediators
La première ligne de défense contre un virus est l’immunité innée non spécifique qui se manifeste par la sécrétion de molécules antivirales et pro-inflammatoires. Les cellules reconnaissent le virus par des motifs protéiques et d’acides nucléiques qui déclenchent cette immunité innée. En particulier l’ARN naturel du virus, différent d’un ARN humain est détecté par les Toll-like récepteurs (contrairement à l’ARNm vaccinal). La reconnaissance du virus comme un pathogène à éliminer entraîne une cascade d’évènements métaboliques qui peut suffire à éliminer le virus. Des cellules de l’immunité innée contribuent aussi à éliminer le virus : neutrophiles, macrophages, cellules tueuses, etc…
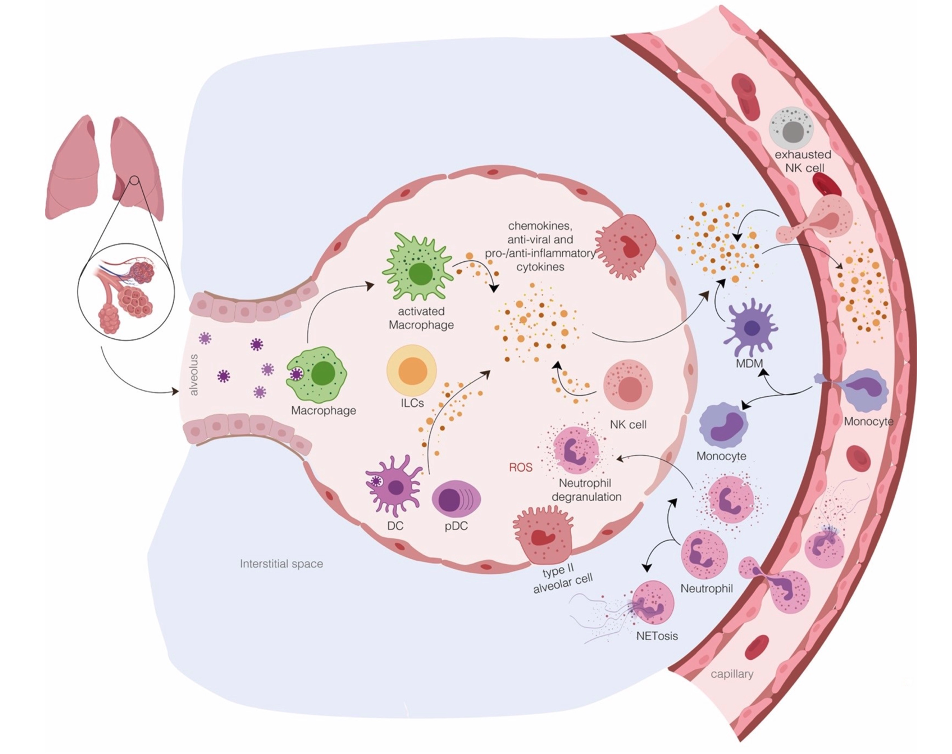
Ricci D et al., 2021, https://www.mdpi.com/1422-0067/22/13/7017 , Innate Immune Response to SARS-CoV-2 Infection: From Cells to Soluble Mediators
2- Immunité adaptative
Extraits d’une revue (7) : Le système immunitaire adaptatif prend le relais si le système immunitaire inné ne parvient pas à détruire les germes. Il cible spécifiquement le type de germe à l’origine de l’infection. Mais pour ce faire, il doit d’abord identifier le germe. Cela signifie qu’il est plus lent à réagir que le système immunitaire inné, mais lorsqu’il le fait, il est plus précis. Il a également l’avantage de pouvoir se « souvenir » des germes, de sorte que la prochaine fois qu’un germe connu est rencontré, le système immunitaire adaptatif peut réagir plus rapidement.
Grâce à cette mémoire, certaines maladies ne peuvent être contractées qu’une seule fois dans la vie : Le système immunitaire adaptatif met quelques jours (maximum 14 jours concernant la Covid) à réagir la première fois qu’il entre en contact avec le germe, mais la fois suivante, le corps peut réagir immédiatement. La deuxième infection n’est alors généralement même pas remarquée, ou du moins elle est moins grave.
Le système immunitaire adaptatif repose sur les lymphocytes T, les lymphocytes B et les anticorps présents dans le sang et les autres fluides corporels.

Les cellules de l’immunité innée et de l’immunité adaptative
-Les lymphocytes T ( appelés T car ils ont été découverts dans le thymus) sont produits dans la moelle osseuse, puis se déplacent vers le thymus par la circulation sanguine, où ils arrivent à maturité.
Les cellules T ont trois fonctions principales :
Elles utilisent des molécules pour activer d’autres cellules du système immunitaire qui vont lancer le système immunitaire adaptatif (cellules T auxiliaires).
Elles détectent les cellules infectées par des virus ou les cellules tumorales et les détruisent (cellules T cytotoxiques).
Certaines cellules T auxiliaires deviennent des cellules T à mémoire après que l’infection a été vaincue. Elles peuvent « se souvenir » des germes qui ont été vaincus et sont alors prêtes à activer rapidement le système immunitaire adapté en cas de nouvelle infection.
Les cellules T possèdent des caractéristiques de détection sur leurs surfaces qui peuvent s’attacher aux germes. Le système immunitaire peut produire en quelques jours un type de cellule T correspondant à chaque germe présent dans une infection.
Ensuite, si un germe se fixe sur un lymphocyte T correspondant, ce dernier commence à se multiplier, créant ainsi d’autres lymphocytes T spécialisés dans ce germe. Comme seules les cellules qui correspondent au germe se multiplient, la réponse immunitaire est spécifique.
-Les lymphocytes B (cellules B) sont fabriqués dans la moelle osseuse et y mûrissent pour devenir des cellules spécialisées du système immunitaire. Ils tirent leur nom du « B » de « bourse de Fabricius », un organe que seuls possèdent les oiseaux et chez qui ils ont été découverts.
Les cellules B sont activées par les cellules T auxiliaires. Elles se multiplient alors et se transforment en plasmocytes. Ces plasmocytes produisent rapidement de très grandes quantités d’anticorps et les libèrent dans le sang. Certaines des cellules B activées se transforment en cellules mémoire et font partie de la « mémoire » du système immunitaire adaptatif.
Les différentes cellules du système immunitaire adaptatif communiquent soit directement, soit par l’intermédiaire de molécules solubles tels que les cytokines (petites protéines).
-Les anticorps sont des glycoprotéines (composés formés de protéines et de sucres ou glucides) qui circulent dans le sang. Ils sont produits par les plasmocytes (cellules B) et sont spécifiques des antigènes des pathogènes auxquels ils se lient.
Sérologie ou mesure des anticorps circulants dans le sang
C’est la mesure des anticorps spécifiques produits contre le SARS-CoV-2, virus responsable de la Covid-19
Rappel, séroprévalence :
J’ai donné récemment (1) quelques mesures de séroprévalence (proportion de la population ayant des anticorps : 1/3 de la population au Kenya en novembre 2020, 25% en Inde en janvier 2021, 23% en France, 50% aux USA, 40% à Madagascar). Depuis de nouvelles données sont sorties :Tchéquie : 51% de séropositifs en février/mrs 2021, Estonie : 77% de positifs au 27 septembre 2021 (8). En Estonie, seuls les anticorps anti-N ont été mesurés et donc cette étude ne prend bien en compte que l’immunité naturelle (N n’est pas incluse dans le vaccin) et ne peut comptabiliser les anticorps induits par le vaccin.
Les tests disponibles
Il existe différentes techniques de détection des anticorps et tous les tests ne détectent pas des anticorps dirigés contre les mêmes antigènes du SARS-CoV-2 : en général il s’agit des anticorps dirigés contre la protéine S (spike), soit entière, soit seulement le RBD (domaine de liaison du récepteur), ou contre la nucléocapside N (protéine liée à l’ARN du virus).
Les réponses immunes des personnes ayant rencontré le virus sont très hétérogènes et certaines peuvent ne pas produire d’anticorps contre l’un ou l’autre des antigènes du virus. De plus les mutations des variants sont nombreuses sur le RBD de la spike, sur la spike entière et en moindre mesure sur la protéine N. Selon le variant auquel a été confronté le patient, les anticorps produits pourraient donc ne pas être détectés par certains tests sérologiques.
- La HAS autorise 17 tests sérologiques (9).
- La Commission Européenne recense 588 tests de recherche d’anticorps anti-Covid avec la marque CE et 158 sans marque CE (10).
- Au 12 octobre 2021, la FDA autorise 89 tests (11)
L’OMS a rendu disponible un étalon international de référence pour le dosage des anticorps anti-SARS-CoV-2.(12). Mais il est obtenu à partir de sang de convalescents prélevés avant juin 2020, donc avant l’émergence des variants. Les sérums sont prélevés plus de 28 jours après le début des symptômes mais il n’est pas précisé la durée maximum après symptômes : il ne donnera pas d’indication sur les prélèvements effectués trop longtemps après l’infection.
La mesure des anticorps neutralisants est pratiquée sur des souches de 2020 et pourrait ne pas être reproductible avec les variants récents.
De très fortes variations apparaissent entre les laboratoires qui testent ces pools de sérums.
Aucun laboratoire français n’a participé à cette évaluation.
Pour le pool à taux faible, très peu de laboratoires utilisant des kits commerciaux ont donné un résultat quantitatif : la moyenne et la variabilité n’ont pu être calculées.
Pour toutes ces raisons, il est donc difficile de se fier aux résultats quantitatifs calculés à partir de cet étalon et rendus fin 2021, et surtout pour les taux faibles d’anticorps.
Evaluation des tests sérologiques
Les performances de ces tests sérologiques varient considérablement, certains tests étant loin de répondre aux critères de sensibilité et d’efficacité proposés par la FDA. En particulier, certains tests sérologiques ont montré que la sensibilité à un stade précoce de l’infection est beaucoup plus faible que celle à un stade avancé de l’infection. (13)
On trouvera dans un article de revue (14), la description complète de tous les tests sérologiques utilisés ainsi que toutes les causes nombreuses de faux positifs (en particulier chez des malades atteints de maladies auto-immunes) et faux négatifs.
Selon de récentes publications, le taux d’anticorps dépend de la sévérité de la maladie: Les convalescents ayant présenté une forme bénigne de Covid sont plus susceptibles d’avoir un taux d’IgG indétectable après plusieurs mois. (15) (16)
Ceci confirme ce qui avait déjà été publié en 2020 (5). Quelques études montrant la corrélation entre sévérité de la maladie et taux d’anticorps :
- 40% des asymptomatiques sont séronégatifs,
- 12,9% des symptomatiques aussi dans le début de la convalescence. (17)
- Selon Wu F. et al., 2020, 30% des rétablis ont un taux faible d’anticorps. (18)
- Selon Toh ZQ et al., 2021, une proportion plus faible d’enfants séroconvertit par rapport aux adultes [20/54 (37,0 %) contre 32/42 (76,2 %)]. (19). Ce phénomène n’est pas lié à la charge virale, qui est similaire chez les enfants et les adultes [Ct moyen 28,58 vs 24,14 ]. L’âge et le sexe n’ont pas non plus influencé la séroconversion ou l’ampleur de la réponse des anticorps chez les enfants ou les adultes. Chez les adultes (mais pas chez les enfants), les adultes symptomatiques présentaient des taux d’anticorps trois fois plus élevés que les adultes asymptomatiques. Des preuves d’immunité cellulaire ont été observées chez les adultes qui ont séroconverti mais pas chez les enfants qui ont séroconverti (mais on peut difficilement conclure étant donné le faible effectif observé).
Selon Lui W et al (20) la maladie clinique ne garantit pas la séroconversion et les laboratoires disposant de tests RT-PCR très sensibles sont plus susceptibles de détecter les non-répondants sérologiques. Ces résultats fournissent une explication à la variabilité déconcertante de la séroconversion dans les différentes cohortes. 36% de leur cohorte représentaient des non-répondants sérologiques.
Selon Masia M et al, (21) 25 % des patients ont présenté des titres d’anticorps indétectables. (20) Les patients qui n’ont pas séroconverti présentaient des valeurs de seuil de cycle plus élevées pour la RT-PCR (38,0 contre 28,0 ), un délai plus court pour la clairance virale (3,0 contre 41,0) et étaient plus susceptibles d’avoir le SRAS-CoV-2 détecté uniquement sur des échantillons de selles. Les non-séroconvertis présentaient également des niveaux plus faibles de biomarqueurs inflammatoires sanguins à l’admission et une gravité moindre de la maladie. La sérologie a été effectuée pour les anticorps anti-S1 et anti-N.
Le résultat dépend du temps écoulé entre l’infection et le test sérologique :
Un pourcentage important de la population infectée peut présenter une sérologie négative dans les mois suivant l’infection et la réponse sérologique des IgG aux cibles du SARS-CoV-2 est hétérogène ; ces cibles sont : la protéine spike et la protéine N (nucléocapside). Il y a hétérogénéité de réponse selon les patients et pas seulement selon la gravité de l’infection. (15)
Selon une étude internationale de mars 2021 (22), un an après les symptômes, 36% des IgG anti-S seulement persistent, 31% des IgG anti RBD,et 7% des IgG anti-N persistent; les IgM et IgA disparaissent rapidement. Une modélisation permet d’étendre la durée d’observation de 1 an maximum jusqu’à 2 ans :
Au bout de 6 mois, à peine la moitié (55% ) des IgG anti spike persistent, 36% persistent 12 mois et 16% 24 mois. Moins de la moitié des autres anticorps détectés 15 jours après l’infection persistent (que ce soient les IgG anti RBD, antiN, IgM antiS, RBD ou antiN, IgA anti S, RBD et N)

Un des meilleurs tests selon une équipe française (23) serait le test chinois Wantai dosant les anticorps totaux(IgG, IgM anti RBD de spike) : (24)
C’est un des tests les plus sensibles et spécifiques d’après le fabricant Bioscience. (25)
Les tests les plus utilisés détectent des antigènes différents avec des sensibilités et des spécificités différentes :Selon une étude européenne, on note des différences substantielles de sensibilité et de spécificité selon les laboratoires et selon que les réactifs sont certifiés ou non, le manque d’harmonisation est très net. (26)
Selon une étude canadienne, seul un test commercial s’approche des standards exigés par Health Canada (16)
Les tests ont été conçus à partir des antigènes de la souche de référence isolée à Wuhan en 2019
Depuis, le virus a énormément muté et certains antigènes des variants circulants actuellement pourraient induire la synthèse d’anticorps non reconnus par les tests sérologiques, problème évoqué par Banoun (27). Certains tests pourraient donner des faux négatifs chez les personnes infectées par des variants éloignés : cette éventualité est soulignée par la FDA mais ne semble pas encore évaluée à ce jour (28).
Selon un récent rapport britannique (29), la séroprevalence mesurée par le test Roche anti-N donne un maximum de 25 à 30% de séropositivité selon les régions et les âges. Ce rapport note l’affaiblissement de la réponse des anticorps N au fil du temps. Les niveaux d’anticorps N semblent être plus faibles chez les individus qui contractent l’infection après deux doses de vaccination, comme expliqué précédemment (1) la vaccination peut endommager la capacité du système immunitaire à répondre à l’infection.
De juin à septembre 2021, le profil des niveaux d’anticorps dans ces cohortes diminue progressivement, ce qui correspond à un déclin. Au début de la campagne de vaccination en décembre, les taux d’anticorps se situaient généralement dans une fourchette de 0,8 à 1 000 UA/ml, alors qu’après la vaccination, les taux d’anticorps dépassent généralement 1 000 UA/ml. Les taux d’anticorps sont globalement plus élevés chez les personnes qui ont déjà été infectées ; on s’attend à ce que la vaccination après l’infection et la réinfection après la vaccination augmentent les taux d’anticorps existants.
L’idée actuelle est qu’il n’existe pas de niveau d’anticorps seuil offrant une protection totale contre l’infection, mais qu’au contraire, des niveaux d’anticorps plus élevés sont susceptibles d’être associés à une moindre probabilité d’infection.
Immunité cellulaire
C’est la recherche des cellules mémoires capables de reconnaître immédiatement le virus et de déclencher une réponse rapide Selon une étude française du CHU de Strasbourg (30), la sérologie (détection des anticorps spécifiques) pour détecter l’infection par le SARS-CoV-2 n’est absolument pas fiable : on observe une absence d’anticorps mais une solide immunité cellulaire chez des personnes pauci ou asymptomatiques.
Cette immunité cellulaire peut être évaluée par le test ELISpot ( interferon-gamma (IFN-γ) enzyme linked immunospot ) : dans cette étude, les cellules mononucléées du sang périphérique sont prélevées et stimulées avec un pool de peptides couvrant la protéine spike mais aussi les autres protéines structurales et non structurales du SARS-CoV-2. Ensuite la synthèse d’interféron γ par les cellules T stimulées a été mesurée. Des patients contacts de personnes modérément atteintes de Covid ont développé des symptômes du Covid. Ils sont séronégatifs mais présentent une immunité cellulaire contre le SARS-CoV-2.
Les sérologies ont été effectuées avec 3 tests différents (dont l’une utilisant la technique « lateral flow ») et les épitopes testés sont la nucléoproteine et la proteine spike du SARS-CoV-2
Donc la réponse cellulaire est plus sensible que la sérologie. Un contact asymptomatique développe aussi une réponse cellulaire. L’explication pourrait être que l’exposition à de faibles doses de virus pourrait induire une brève réplication du virus chez ces contacts : l’immunité innée pourrait faire avorter une réplication correcte du virus.Concernant la détection des personnes ayant été infectées par la Covid-19, la recherche d’anticorps conduit donc à une sous-estimation de l’exposition.
Pratiquement tous les patients testés (sains, index et contacts) ont une réponse à la spike des HCoVs (coronavirus de rhume banal). Ceci confirme également ce qui a été publié dès 2020 sur l’immunité croisée avec les coronavirus de rhume banal (5).
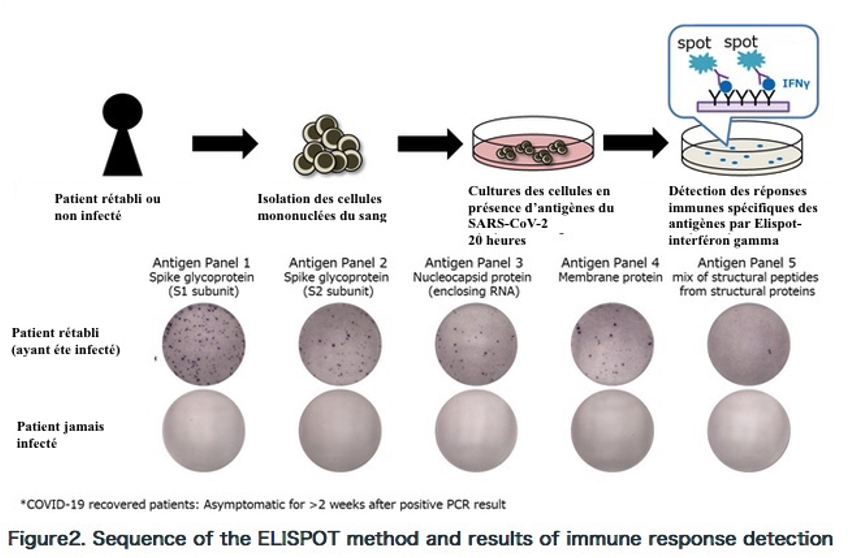
Description du test : https://www.kobe-u.ac.jp/research_at_kobe_en/NEWS/collaborations/2020_12_24_01.html
Un réactif commercial est disponible en France : Elispot Cerba (31) : malheureusement ce test coûte cher (environ 200€) et n’est pas remboursé par les assurances maladie.
Le test consiste à mesurer la réponse cellulaire spécifique vis-à-vis de plus de 250 peptides des protéines Spike (S) et de Nucléocapside (N) du SARS-CoV-2 en quantifiant le nombre de lymphocytes T produisant de l’interféron γ. Les lymphocytes du malade ou du patient vacciné sont isolés puis mis en contact avec les antigènes du virus, après 20 heures d’incubation, on mesure la production d’interféron γ. Un test positif permet de différencier l’immunité liée à l’infection par le virus (positivité anti-S et anti-N) d’une immunité liée à la vaccination (positivité anti-S seule).
Un réactif britannique existe et a été évalué également : T-Spot.Covid de Oxford Immunotec Ltd est disponible au Royaume Uni (32) il a été évalué par Public Health (Wyllie D et al., 2021) et par Kruse et al., 2021.
Conclusion
Avant l’institution de la troisième dose, les autorités de santé recommandaient de n’injecter qu’une seule dose de vaccin aux personnes déjà infectées; elles demandaient donc de faire une sérologie avant injection mais ceci n’était pas obligatoire. À ce jour aucune recommandation claire n’est émise concernant une éventuelle seconde dose pour les personnes déjà infectées.
La sérologie (mesure du taux d’anticorps spécifiques anti-SARS-CoV-2) donne des résultats hétérogènes selon les individus, le temps écoulé depuis l’infection, la sévérité des symptômes observés lors de l’infection, le réactif utilisé, le laboratoire effectuant l’analyse. Les taux faibles d’anticorps sont difficilement interprétables, elle n’est donc pas suffisante en cas de résultat négatif. Il est possible de mesurer l’immunité cellulaire spécifique anti-Covid mais ce test est cher et non remboursé.
Hélène Banoun
Octobre 2021
Notes et sources:
(1) Banoun, 2021a, Covid-19 : Immunité naturelle versus immunité vaccinale, Octobre 2021 https://www.researchgate.net/publication/354985184_Covid-19_Immunite_naturelle_versus_immunite_vaccinale
(2) Sonigo et al., 2021.17 SEPTEMBRE 2021 – FAUT-IL VACCINER CONTRE LA DÉTECTION PAR PCR OU CONTRE LA MALADIE COVID-19 ?, https://www.jle.com/fr/covid19-vacciner-contre-detection-par-PCR-ou-contre-maladie-covid19)
(3) HAS, 12 février 2021, https://www.has-sante.fr/jcms/p_3237456/fr/une-seule-dose-de-vaccin-pour-les-personnes-ayant-deja-ete-infectees-par-le-sars-cov-2
(4) HAS, 16 juillet 2021, https://www.has-sante.fr/jcms/p_3278140/fr/vaccination-contre-la-covid-19-pas-de-dose-de-rappel-pour-le-moment-en-dehors-des-plus-vulnerables-et-des-plus-ages?portal=p_3058934
(5) Banoun, 2020, Covid19 : immunité croisée avec les autres coronavirus, phénomènes immunopathologiques-update-aout2020 https://hal.archives-ouvertes.fr/hal-02914300
(6) Majdoul et Compton, 2021, Lessons in self-defence: inhibition of virus entry by intrinsic immunity, https://doi.org/10.1038/s41577-021-00626-8
(7) Cologne, Germany: Institute for Quality and Efficiency in Health Care (IQWiG),The innate and adaptive immune systems, https://www.ncbi.nlm.nih.gov/books/NBK279396/
(8) Tchéquie, Estonie, 2021 (Tchéquie, Piler P et al., 2021, Dynamics of seroconversion of anti-SARS-CoV-2 IgG antibodies in the Czech unvaccinated population: nationwide prospective seroconversion (PROSECO) study https://www.medrxiv.org/content/10.1101/2021.08.15.21262007v1 ,
Estonie https://www.ut.ee/en/research/study-prevalence-coronavirus-estonia
https://www.ut.ee/sites/default/files/styles/ut_content_width/public/eng-antikehade-analsitulemused_2.png?itok=umXfBmP9
Jogi P et al.,Seroprevalence of SARS-CoV-2 IgG antibodies in two regions of Estonia (KoroSero-EST- 1) https://www.medrxiv.org/content/10.1101/2020.10.21.20216820v1.full.pdf
(9) Covid-19 Santé Gouv.fr, 2021, Covid-19 Santé Gouv.fr, 2021, https://covid-19.sante.gouv.fr/tests
(10) CE, 2021 , COVID-19 In Vitro Diagnostic Medical Devices https://covid-19-diagnostics.jrc.ec.europa.eu/devices?device_id=&manufacturer=&text_name=&marking=Yes&method=&rapid_diag=&target_type=1&field-1=HSC+common+list+%28RAT%29&value-1=0&search_method=AND#form_content
(11) FDA, 2021, In Vitro Diagnostics EUAs – Serology and Other Adaptive Immune Response Tests for SARS-CoV-2 https://www.fda.gov/medical-devices/coronavirus-disease-2019-covid-19-emergency-use-authorizations-medical-devices/in-vitro-diagnostics-euas-serology-and-other-adaptive-immune-response-tests-sars-cov-2
(12) OMS, 2020, Establishment of the WHO International Standard and Reference Panel for anti-SARS-CoV-2 antibody https://www.who.int/publications/m/item/WHO-BS-2020.2403
(13) Gong F. et al., 2021, Evaluation and Comparison of Serological Methods for COVID-19 Diagnosis https://www.frontiersin.org/article/10.3389/fmolb.2021.682405
(14) Liu G et al., 2021, COVID-19 Antibody Tests and Their Limitations https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC7885805/
(15) Perez-Olmeda M. et al., 2021, Evolution of antibodies against SARS-CoV-2 over seven months: experience of the Nationwide Seroprevalence ENE-COVID Study in Spain
https://www.medrxiv.org/content/10.1101/2021.03.11.21253142v1
(16) Therrien C. et al., 2021, Multicenter Evaluation of the Clinical Performance and the Neutralizing Antibody Activity Prediction Properties of 10 High-Throughput Serological Assays Used in Clinical Laboratories,https://pubmed.ncbi.nlm.nih.gov/33303562/
(17) Long Q-X et al., 2021, Clinical and immunological assessment of asymptomatic SARS-CoV-2 infections https://www.nature.com/articles/s41591-020-0965-6
(18) Wu F, Wang A, Liu M, et al., 2020, Neutralizing antibody responses to SARS-CoV-2 in a COVID-19 recovered patient cohort and their implications. https://www.medrxiv.org/content/10.1101/2020.03.30.20047365v2
(19) Toh ZQ et al., 2021,Reduced seroconversion in children compared to adults with mild COVID-19 https://www.medrxiv.org/content/10.1101/2021.10.17.21265121v1
(20) Lui W et al., 2021, Predictors of Nonseroconversion after SARS-CoV-2 Infection https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC8386781/
(21) Masia M et al, 2021 , SARS-CoV-2 Seroconversion and Viral Clearance in Patients Hospitalized With COVID-19: Viral Load Predicts Antibody Response, https://doi.org/10.1093/ofid/ofab005
(22) Pelleau S. et al., 2021, Serological reconstruction of COVID-19 epidemics through analysis of antibody kinetics to SARS-CoV-2 proteins https://www.medrxiv.org/content/10.1101/2021.03.04.21252532v1
(23) Velay A. et al., 2021, Evaluation of the performance of SARS-CoV-2 serological tools and their positioning in COVID-19 diagnostic strategies https://pubmed.ncbi.nlm.nih.gov/32957073/
(24) Wantai , FDA https://www.fda.gov/media/140929/download
(25) Bioscience, https://www.bioscience.co.uk/cpl/sars-cov-2-ab-elisa
(26) Ast V. et al., 2021, Assessing the quality of serological testing in the CoViD-19 pandemic: results of a European external quality assessment (EQA) scheme for anti-SARS-CoV-2 antibody detection https://journals.asm.org/doi/10.1128/JCM.00559-21
(27) Banoun, Evolution of SARS-CoV-2: review of mutations, role of the host immune system
Banoun H, Nephron (2021 Apr 28:1-12) , https://www.karger.com/Article/Abstract/515417
(28) FDA, 23 /09/2021, https://www.fda.gov/medical-devices/coronavirus-covid-19-and-medical-devices/sars-cov-2-viral-mutations-impact-covid-19-tests
(29) COVID-19 vaccine surveillance report Week 42 https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/1027511/Vaccine-surveillance-report-week-42.pdf
(30) Gallais et al., 2020, Intrafamilial exposure to Sars-cov-2 induces cellular immune response without seroconversion
https://wwwnc.cdc.gov/eid/article/27/1/20-3611_article
(31) Cerba https://www.lab-cerba.com/home/vous-informer/news/sars-cov-2–un-nouveau-test-dans.html
(32) https://www.tspotcovid.com


Commentaires
Enregistrer un commentaire