Les questions auxquelles les autorités sanitaires doivent répondre
De : https://peterhalligan.substack.com/p/lingering-questions-for-each-of-your?
Questions à poser aux régulateurs de la santé de votre pays sur le déploiement de l'injection de C19
1. Quelles preuves aviez-vous que l'utilisation d'instructions d'ARNm pour fabriquer la protéine de pointe provoquerait une réponse immunitaire déjà affaiblie et compromise chez les personnes âgées et infirmes ?
2. Lors de votre examen des données d'innocuité et d'efficacité de l'essai clinique de phase 3 sur l'injection d'ARNm de Pfizer C19, quelles différences avez-vous observées par rapport à l'analyse présentée aux pages 11 et 12 du jeu de diapositives en lien ci-dessous :
Les vaccinations COVID-19 - Plus de mal que de bien Vidéo et impression
3. L'essai clinique de phase 3 de Pfizer a été ouvert des mois avant la date de fin prévue de l'essai, le 31 janvier 2021. Vous avez accordé une autorisation d'utilisation d'urgence le 10 décembre 2020. Quelles étaient vos raisons pour autoriser la validité des résultats de l'essai clinique après l'ouverture de l'essai clinique et pour approuver sous EUA 52 jours plus tôt pour un essai de 192 jours ?
4. Quelles informations de suivi sur les infections et les événements indésirables Pfizer vous a-t-il fournies sur chaque individu dans chacun des groupes de contrôle et de placebo après la levée de l'étude de l'essai 52 jours avant sa durée prévue de 6 mois ?
5. Le seul objectif pré-spécifié des essais cliniques des injections de C19 était de réduire la gravité des symptômes. Deux autres paramètres cliniques – la prévention de la transmission ou de l'infection et la réduction des hospitalisations ou des décès – n'étaient pas requis. Pourquoi n'avez-vous pas alerté le grand public à ce sujet et pourquoi n'avez-vous pas insisté pour que les fabricants divulguent ce fait afin de faciliter le consentement éclairé ?
Dans le rapport post AMM ici :
reissue_5.3.6-postmarketing-experience.pdf (phmpt.org)
Notez que bien que 126 millions de doses aient pu être expédiées, moins de 70 millions de doses ont probablement été administrées. Vous pouvez voir que la grande majorité des 41 086 rapports de cas pour 168 895 événements se sont produits aux États-Unis et dans les pays de l'UE.
En utilisant les données d' ici et d'ici , le nombre de doses administrées à fin février 2021 était de 38 millions pour les États-Unis et de 29 millions pour l'UE - un total de 67 millions par rapport aux 126 millions expédiés. L'inférence pourrait être tirée que 63 millions de personnes avaient reçu les deux doses de l'injection d'ARNm Pfizer C19 sur la base du nombre de doses expédiées, alors qu'en fait 33,5 millions de personnes ont effectivement reçu la première série d'injections à deux doses.
6. Avez-vous évalué le rapport des événements indésirables (événements sur personnes ou événements sur doses) qui refléterait cette différence entre les doses expédiées et les doses administrées ?
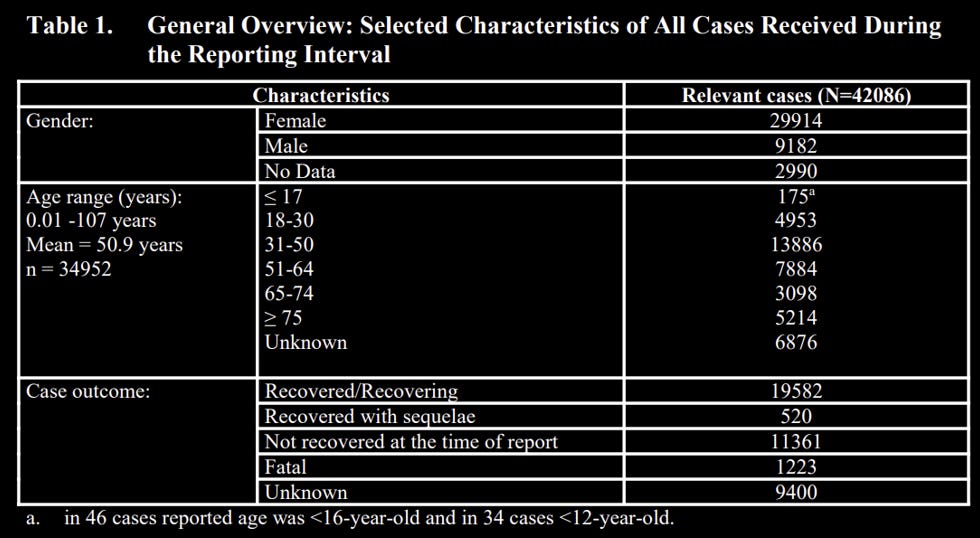
7. Avez-vous évalué le taux d'événements indésirables signalés dans l'essai clinique de phase 3 avec ce (court) rapport post-autorisation de mise sur le marché de 3 mois pour évaluer le nombre de rapports d'événements indésirables qui n'étaient PAS inclus dans le rapport post-autorisation de mise sur le marché de Pfizer au 28 février 2021 ? Quelles instructions de suivi avez-vous données à Pfizer pour les 9 400 résultats "Inconnus" ou les 11 361 "Non récupérés" ou la recherche des 20 000 "Récupération" ou récupérés sur les 42 086 rapports sur les individus ?
Par exemple, les données de l'essai clinique de phase 3 de Pfizer ont indiqué un taux de 5 241 événements indésirables parmi 21 921 dans le groupe injecté, soit un taux de 24 %. Il y a eu 262 événements indésirables graves (changeant la vie) dans le groupe injecté – un taux de 1,2 % parmi ceux qui avaient terminé la série initiale. Il y a eu 127 événements graves (mettant la vie en danger) – 0,6 %.
Pour les 33,5 millions de personnes ayant reçu deux doses d'ARNm Pfizer/BioNTech C19 (série initiale d'injections) au cours du (court) rapport post-autorisation de mise sur le marché de 3 mois, il y aurait eu plus de 8 millions d'événements indésirables, 400 000 événements indésirables graves et 200 000 événements indésirables graves.
Les mêmes questions s'appliquent aux essais cliniques pour Moderna, Johnson and Johnson, AstraZeneca et tous les autres.
8. Combien de flacons contenant des doses d'injections de C19 expédiées avez-vous testées pour vous assurer que le contenu correspondait au contenu des doses d'essai clinique ? À quelle fréquence avez-vous répété ces tests – quotidiennement, hebdomadairement, trimestriellement ou semestriellement ? Après avoir terminé ces tests, le cas échéant, combien de flacons avez-vous rejeté ?
Il y a beaucoup plus de questions sur la fraude et la négligence dans les essais cliniques qui se trouvent dans le lien ci-dessus. Nous recevrons sous peu le rapport post-autorisation de mise sur le marché de Moderna pour les États-Unis.
L'un des plus grands problèmes en suspens qui n'est abordé par aucune étude est l'impact des injections de C19 sur d'autres médicaments pris par les personnes dans la population générale - par âge et par sexe. Nous ne nous concentrons pas non plus sur cet impact des mois ou des années après les injections. Des événements indésirables seraient-ils attribués aux médicaments autres que C19 ou aux injections de C19 ?
L'organisme de réglementation de la santé de chaque pays avait accès à ces informations – ou aurait dû y avoir accès.
Nous savons que les contrats négociés avec Pfizer et al, stipulaient essentiellement "nous fournirons, mais ne garantirons rien, cela dépend de vous en tant que gouvernement représentatif et régulateur".
Espérons que les réponses à ces questions aboutiront à un autre paradigme « PLUS JAMAIS »
Courage !




Commentaires
Enregistrer un commentaire