Les vaccins contre la Covid sont indiscernables des armes biochimiques.
- Obtenir le lien
- X
- Autres applications
https://sashalatypova.substack.com/p/my-testimony-for-the-case-in-the?
Mon témoignage écrit dans le cadre de l'affaire aux Pays-Bas contre les instigateurs du démocide mondial faussement présenté comme la « réponse à la pandémie de Covid-19 ».
Ce texte est très long car il contient l'intégralité de mon témoignage écrit destiné au tribunal néerlandais. Il est structuré comme suit :
Contexte de l'affaire et liens vidéo vers la chaîne YouTube RechtOprecht
La couverture médiatique de l'affaire
La campagne de diffamation
Résumé de mon témoignage
Témoignage complet
1. Contexte de l'affaire :
Pour ceux qui ne connaissent pas cette affaire, voici un court message vidéo de Peter Stassen, le seul avocat encore en poste. Son collègue, Arno van Kessel, a été emprisonné sur la base d'accusations de terrorisme [fabriquées de toutes pièces] et radié du barreau.
2. La couverture médiatique :
Un article récent du Defender propose un excellent résumé de l'affaire et des développements survenus à ce jour :
Des experts témoignent : les vaccins contre la COVID sont « indiscernables des armes biologiques ».
Lors de la conférence de presse, Stassen a également évoqué ses efforts pour que les tribunaux néerlandais acceptent les témoignages en personne de ses experts. Il a déclaré que ces derniers entendaient présenter des preuves démontrant que les vaccins contre la COVID-19 :
Sont « indiscernables des armes biologiques ».
N’offre « aucun avantage social ».
Ne sont « ni sûres ni efficaces ».
Ont été mis sur le marché aux États-Unis dans le cadre d' une autorisation d'utilisation d'urgence , « un statut juridique qui supprime l'application de la loi pharmaceutique et les garanties pour les consommateurs par la FDA », ou l'Agence américaine des produits alimentaires et médicamenteux.
Sont « conçus pour provoquer, de par leur conception, les dommages décrits dans la notice et les rapports comme étant des " effets secondaires " — notamment " la mort subite , l'insuffisance cardiaque , le cancer et les maladies les plus horribles".
Constituent un « élément clé » de la « Grande Réinitialisation », « un projet militaire dans lequel l’OTAN joue un rôle important ».
Voici un article paru dans un journal néerlandais sur cette affaire (cliquez sur le bouton de traduction anglaise) : « Le tribunal ordonne aux accusés de se présenter en personne à l’audience ».
Voici mon court témoignage vidéo, résumant mon affidavit écrit (fourni intégralement, moins 1 Go de pièces jointes, ci-dessous) :
Des résumés vidéo de Mike Yeadon, Katherine Watt, Catherine Austin Fitts et Joe Sansone, ainsi que d'autres interviews vidéo, sont disponibles sur cette chaîne YouTube .
3. La campagne de diffamation :
J'essaie généralement d'éviter d'intégrer des futilités des réseaux sociaux à mes articles, mais ces informations sont cruciales et pertinentes, et méritent d'être abordées. Si vous suivez Jikky Leaks (alias Mouse Piss) et son « armée de souris » (alias Moussad) sur X, ou si vous suivez Dr Ah Kahn Syed (la même personne que Jikky sur X), ou OpenVAET (alias « canceledmouse » sur X) et tous ces autres agitateurs, trolls connus ou anonymes arborant un logo de souris dans leur profil, soyez vigilants ! Il s'agit d'un réseau d'agents financés par les services de renseignement militaires et privés, dont la mission est de provoquer des conflits et de « semer la confusion » (terme du renseignement) en générant une multitude de contenus en apparence pertinents. Leur objectif est de semer la confusion et de détourner l'attention des véritables enjeux de l'enquête. Par exemple, ils cherchent à nous éloigner du droit, des cadres réglementaires et du droit militaire pour nous entraîner dans des débats interminables et stériles sur la « méthode scientifique de référence ». On les appelle souvent « agents du chaos » – le chaos, ou la désorganisation, par opposition au cosmos, ou à la structure et à la clarté. Ces opérations visent également à discréditer ceux qui sont sur la bonne voie concernant la lutte contre la COVID-19 et, surtout, qui réalisent des progrès tangibles. Les agents mentionnés ci-dessus prétendent être du bon côté en publiant de nombreux documents techniquement valides et en critiquant les vaccins. Cependant, ils insistent pour que l'on s'en prenne uniquement à l'industrie pharmaceutique et que l'on reste cantonné au débat sur la « science de référence ». Comme mes lecteurs le savent, le véritable crime commis pendant la pandémie de COVID-19 n'a rien à voir avec la science. Il s'agit d' une attaque militaire mondiale coordonnée contre la société , financée par des budgets et des contrats militaires, qui a consisté à commander des substances et des protocoles indiscernables d'armes auprès de complices du secteur privé au sein des grandes entreprises de santé et pharmaceutiques.
Voici les mensonges immédiats de Jikky en réponse à l'article du Defender dont j'ai donné le lien ci-dessus :
Notez que tout ce qu'il écrit à mon sujet est mensonger :
Il prétend que je travaille pour l'industrie pharmaceutique – c'est un mensonge, j'ai quitté ce secteur il y a près de 10 ans.
Il prétend que je suis lié au Boston Consulting Group ; c’est faux. Je n’ai aucun lien avec BCG, je n’y ai jamais travaillé et je n’ai même jamais participé à un contrat où ils étaient parties prenantes.
Il prétend que je « fais dérailler » les procès et mentionne l'affaire Kirk Moore ! C'est vraiment touchant ! Les documents que Katherine Watt et moi avons fournis ont été déterminants pour que Pam Bondi abandonne les poursuites dans cette affaire. Alors, s'il pense que je « fais dérailler » des affaires, il faut se demander : faire dérailler POUR QUI ? De toute évidence, cela montre pour qui travaille Jikky/Saidi : oui, pour ces personnes-là, je fais effectivement dérailler des affaires.
Voici un collage de plusieurs identités de Jikky Leaks, alias « Mouse Piss » :
Voici la véritable identité de Jikky : un faux « docteur » psychopathe dont la spécialité est d’intimider et d’agresser les femmes. Il n’est pas médecin, cependant ; il passe la quasi-totalité de son temps en ligne à mener des opérations de harcèlement en ligne pour le compte de ceux qui le paient. Ce qui est une bonne nouvelle, car il ne peut plus faire de mal physiquement à personne.
Ça suffit, ces bêtises !
Mon témoignage d'expert écrit, soumis au tribunal le 15 septembre 2025 :
4. Résumé
Portée et avis d'expert :
Sur la base de mon examen des documents réglementaires primaires, des fichiers CMC (Chimie, Fabrication et Contrôle) de Pfizer ayant fait l'objet de fuites, de la législation pertinente aux États-Unis et dans l'UE, et d'autres documents accessibles au public, je suis d'avis, en tant qu'expert, que les injections d'ARNm contre la Covid-19 ont été déployées en vertu de règles militaires de « contre-mesures médicales » qui ont contourné les garanties pharmaceutiques standard, les rendant juridiquement et fonctionnellement indiscernables d'une potentielle arme biochimique.
1. La double nature des plateformes ARNm/ADN
Désignation « à double usage » établie – Depuis au moins 1997, les conseillers de la défense américaine (groupe JASON) et plus tard les Académies nationales américaines ont répertorié les plateformes de thérapie génique, y compris les systèmes d’ARNm à base de nanoparticules lipidiques (LNP) utilisés comme vaccins, comme des technologies pouvant être militarisées (par exemple, en administrant des toxines, des oncogènes ou des micro-ARN immunosuppresseurs).
Facilité d'utilisation à des fins militarisées – Les mêmes attributs qui rendent l'ARNm attrayant pour la thérapie (pénétration cellulaire, forte expression) le rendent également attrayant pour une utilisation hostile ; même l'ARN fragmenté (shRNA, miRNA) peut déréguler l'expression des gènes de l'hôte sans coder pour des protéines.
2. « Appât et substitution » : les consommateurs du monde entier ont été induits en erreur quant au statut juridique des produits Covid-19 en tant que contre-mesures – médicaments utilisés à des fins non médicales, c’est-à-dire comme armes.
Les mesures de protection des consommateurs habituellement en vigueur ont été supprimées pour les produits à ARNm Covid-19 :
Réglementation relative aux nouveaux médicaments expérimentaux/Supervision par les comités d'éthique de la recherche : Les produits anciennement développés comme thérapies géniques ont été reclassés comme « vaccins/contre-mesures » sur la seule base de l'usage prévu déclaré ; les dossiers de sécurité-pharmacologie, de cancérogénicité et de mutagénicité ont été supprimés ; les déclarations d'urgence et le statut non expérimental des contre-mesures ont rendu impossible l'application de toutes les réglementations pharmaceutiques.
Inspections des Bonnes Pratiques de Fabrication Actuelles (BPF) : la loi PREP (États-Unis) et le règlement (UE) 2016/369 relatif à l’assistance d’urgence (tel que modifié en 2020) permettent au Secrétaire/Commission de renoncer entièrement aux BPF pendant une urgence CBRN déclarée.
Réglementation relative aux importations et aux exportations et responsabilité du fabricant : levée grâce aux accords d’approvisionnement conclus entre l’UE et les entreprises pharmaceutiques. Indemnisation complète des entreprises pharmaceutiques en cas de blessure ou de décès résultant d’un produit non conforme, sauf en cas de « faute intentionnelle » strictement définie – similaire à la loi américaine PREP dans le cadre des contrats européens.
Tests de lots indépendants dans l'UE : l'accord de reconnaissance mutuelle FDA-EMA (pleinement opérationnel en juillet 2019) permet aux personnes qualifiées de l'UE d'accepter les données de lots américaines sans les avoir vues.
Inspections des installations tous les deux ans (21 CFR 600.21) : la règle de la FDA d'avril 2019 a supprimé la fréquence des inspections et les sanctions ; les interdictions de voyage liées à la Covid ont ensuite complètement interrompu les inspections.
Preuves documentaires de non-conformité aux bonnes pratiques de fabrication et de falsification de produits (utilisation potentielle comme arme) :
Fuites de l'EMA (novembre 2020) – ~1 000 pages révèlent des objections majeures : (i) des emballages cGMP inexistants ; (ii) ≤50 % d'ARNm intact (spécification discrètement abaissée de ≥70 %) ; (iii) validation de la méthode analytique manquante ; (iv) modifications de fabrication non examinées.
Rentschler 2022 Formulaire FDA 483 – Inspection post-déploiement du sous-traitant européen de Pfizer : violations des BPF documentées, confirmant des avertissements antérieurs. Aucune mesure coercitive n’a été prise.
Protection juridique – L’article 360bbb-3a(c) du titre 21 du Code des États-Unis stipule explicitement que même si un produit est « falsifié ou mal étiqueté », il ne peut être considéré comme tel une fois désigné comme mesure de lutte contre l’autorisation d’utilisation d’urgence (EUA). Ces mêmes conditions d’absence de réglementation et de responsabilité ont été mises en œuvre dans l’UE par le biais de contrats d’achat abusifs.
3. Preuves que la réponse à la Covid n'était pas une réponse de santé publique, mais une opération militaire classifiée utilisant des médicaments comme armes.
Toutes les contre-mesures contre la COVID-19, y compris les substances biochimiques commercialisées comme « vaccins sûrs et efficaces », ont été commandées par le département de la Défense (DoD) dans le cadre d'une « démonstration de production à grande échelle » via des contrats relevant de l'autorité de transactions autres (Other Transactions Authority). Selon les rapports de l'opération Warp Speed et du secrétaire adjoint du département de la Santé et des Services sociaux (HHS) chargé de la préparation et de la réponse, le département de la Défense des États-Unis (DoD) a ordonné et supervisé le développement, la fabrication et la distribution de toutes ces contre-mesures.
Le dossier Covid (pièce n° 1) est une compilation de preuves provenant de nombreux pays et régions du monde démontrant que :
La Covid-19 n'était pas un problème de santé publique, bien qu'elle ait été présentée comme telle à la population mondiale. Il s'agissait d'une opération mondiale, coordonnée par des alliances de renseignement et militaires publiques et privées, et faisant appel à des lois conçues pour les attaques aux armes CBRN (chimiques, biologiques, radiologiques et nucléaires).
Le dossier contient des informations relatives à la coordination militaro-industrielle de la riposte à la COVID-19 en matière de biodéfense aux États-Unis, au Royaume-Uni, en Australie, au Canada, aux Pays-Bas, en Allemagne, en Italie et dans de nombreux autres pays. Pour un maximum de pays, le dossier recense les agences militaro-industrielles et de renseignement responsables de la riposte ; les dates de déclaration de l’état d’urgence dans chaque pays ; les agences et organismes liés aux services de renseignement et de renseignement chargés de la censure et de la propagande ; ainsi que les hauts responsables militaires et de renseignement connus ou présumés avoir occupé des postes à responsabilité dans la riposte. Le dossier répertorie également les liens avec les instances dirigeantes internationales, notamment l’UE et l’ONU/OMS, par lesquels la riposte a été coordonnée, et fournit une liste des alliances militaro-industrielles et de biodéfense ayant fourni des cadres multinationaux de riposte à une attaque bioterroriste ou à l’arme biologique.
4. Les injections d'ARNm du Covid-19 sont indiscernables des armes biochimiques.
Les injections d'ARNm contre le Covid-19 répondent à la définition légale de « produit biologique » utilisé comme contre-mesure à des fins non médicales non approuvées, et sont simultanément exemptées de la législation sur la sécurité des médicaments et de la responsabilité des fabricants.
Qualification potentielle en tant qu’« arme biologique » en vertu de l’article 175 et suivants du titre 18 du code des États-Unis (possession ou livraison de tout agent « non raisonnablement justifié par une fin prophylactique ou protectrice ») compte tenu des preuves de falsification et d’étiquetage erroné systématiques.
Prévisibilité des risques – Les directives réglementaires relatives aux thérapies géniques et une abondante littérature scientifique recensent la mutagénèse insertionnelle, l’auto-immunité et l’expression persistante comme des risques connus ; or, ces risques n’ont fait l’objet d’aucun test ni d’aucune divulgation. Le non-respect des BPF, les preuves de falsification et de contamination, ainsi que les lacunes importantes dans la caractérisation du processus de fabrication au moment du lancement mondial témoignent d’une indifférence coupable de la part de l’État et des autorités sanitaires, qui ont délibérément exposé des millions de personnes à un risque de mort ou de blessures graves.
Responsabilité du fait d’autrui – Les défendeurs savaient, ou auraient dû savoir, qu’aucune autorisation pharmaceutique légale n’existait pour les injections d’ARNm contre la Covid-19 et que des millions de personnes étaient exposées à un risque prévisible. Pourtant, ils ont menti au public et mis en œuvre des mesures coercitives pour encourager la vaccination.
Conclusions :
Scientifique – Le danger intrinsèque de double usage des plateformes LNP-ARNm exige un contrôle de fabrication et réglementaire des plus rigoureux ; or, c’est l’inverse qui s’est produit.
Réglementation – Par le biais d’une stratégie mondiale concertée (loi PREP, contre-mesures, réglementations d’urgence de l’UE, accords de reconnaissance mutuelle), le droit coutumier de la sécurité des médicaments a été suspendu, permettant une falsification sans contrôle.
Analyse médico-légale – Les documents divulgués de l'EMA et les conclusions d'inspections ultérieures de la FDA documentent des défaillances objectives de fabrication compatibles avec les voies d'armement décrites dans la littérature américaine sur la biodéfense.
Juridique – En vertu du droit américain et international, un produit livré sous couvert de médicament mais répondant aux critères fonctionnels d'une arme biochimique engage potentiellement la responsabilité pénale de tous les acteurs de la chaîne d'approvisionnement.
Rédigé à l'intention des avocats sous forme de récit de base ; citations détaillées, pièces justificatives et curriculum vitae disponibles sur demande.
5. Témoignage complet :
1. La double nature des plateformes ARNm/ADN
Les armes biologiques et biochimiques sont des substances d'origine naturelle ou synthétique conçues pour provoquer des maladies par l'introduction de toxines et de micro-organismes. Le mode de déploiement d'une arme biochimique dépend de l'agent lui-même, de sa préparation, de sa durabilité et de sa voie d'administration. Les auteurs d'attaques peuvent disperser ces agents par aérosols ou via l'eau et les denrées alimentaires [1] . Outre la dispersion externe de ces agents, l'introduction d'agents biochimiques par d'autres moyens est décrite dans la littérature traitant des armes biochimiques et du terrorisme. Plus précisément, leur utilisation dans des produits de consommation, des médicaments, voire des aliments pour animaux et d'autres produits, a été décrite comme vecteur possible d'attaque [2] .
En politique, en diplomatie et en matière de contrôle des exportations, l’expression « double usage » désigne une technologie susceptible d’être utilisée à des fins à la fois pacifiques et militaires. La technologie de l’ARNm/ADN, notamment sous forme de médicaments injectables ou de vaccins, est depuis longtemps considérée comme une technologie à double usage, potentiellement militarisable [3] , [4] , [5] . Le « dilemme du double usage » a été mis en lumière pour la première fois lors de la découverte du procédé de synthèse et de production à grande échelle de l’ammoniac, qui a révolutionné l’agriculture grâce aux engrais modernes, mais a également conduit à la création d’armes chimiques pendant la Première Guerre mondiale. Ce dilemme est reconnu depuis longtemps en chimie et en physique, ce qui a donné lieu à des conventions et traités internationaux, dont la Convention sur les armes chimiques et le Traité sur la non-prolifération des armes nucléaires.
En 1997, le groupe JASON [6] , un comité consultatif auprès du président américain sur les questions scientifiques relatives aux technologies de guerre, a identifié le potentiel des agents pathogènes génétiquement modifiés dans les six groupes suivants :
Haut du formulaire
Bas du formulaire
Armes biologiques binaires
gènes sur mesure
La thérapie génique comme arme
Virus furtifs
maladies à échange d'hôtes
maladies de créateurs
À ce jour, les systèmes de sensibilisation et de contrôle visant à détecter et prévenir les risques de subversion et d'utilisation abusive restent cruellement insuffisants. Malgré la menace évidente que représentent les produits de biologie synthétique avancée, s'ils sont utilisés à des fins militaires, il n'existe actuellement que très peu, voire aucune, mesure de contrôle, hormis quelques documents d'orientation destinés aux scientifiques et aux institutions de recherche. Ces obligations d'autodéclaration sont largement ignorées et, comme en témoignent les subventions accordées par les NIH à l'Institut de virologie de Wuhan, les recherches susceptibles de susciter des objections sont délocalisées.
1.1. Méthodes d’armement des technologies et produits à ARNm/ADN :
En principe, tout médicament ou produit médical injectable peut être détourné de son usage initial, c'est-à-dire utilisé comme poison. En effet, le consommateur ou le professionnel de santé ne peut évaluer directement le produit et ses ingrédients et doit s'en remettre aux autorités réglementaires chargées de l'application de la législation et de la réglementation pharmaceutiques pour garantir la conformité et la sécurité du produit tout au long de la chaîne de production et de distribution. Les substances pharmaceutiques contiennent des produits chimiques potentiellement dangereux et, généralement, la différence entre un médicament et un poison/une arme mortelle réside dans le dosage précis, que la réglementation pharmaceutique vise à contrôler strictement. Prenons l'exemple des opioïdes utilisés légitimement pour la gestion de la douleur, face à leur risque de surdosage mortel. Un opioïde mal étiqueté, avec un dosage incorrect, serait un exemple de médicament détourné de son usage initial.
D'après la littérature sur les armes biologiques, l'utilisation de la thérapie génique/technologie de l'ARNm ou d'autres plateformes technologiques ADN/ARN à des fins militarisées peut se faire de multiples façons. L'ARNm synthétique est une grosse molécule (plus de 3 000 paires de bases). Instable et fragile, il se fragmente lors de sa fabrication, de son stockage et de son transport. Il a été démontré que des segments d'ARN, tels que les ARN en épingle à cheveux courts (shARN) ou les microARN (miARN), peuvent être exploités comme armes, sans qu'il soit nécessaire de les synthétiser avec précision ni qu'ils codent pour une fonction spécifique.
Le paragraphe suivant se trouve dans le chapitre 6 de l’édition 2018 du manuel « Biodéfense à l’ère de la biologie synthétique » [7] :
Les petits ARN sont un exemple d'information génétique fonctionnelle susceptible d'être transférée horizontalement. Bien qu'ils ne constituent pas une modification du génome à proprement parler, les petits ARN sont importants car ils peuvent moduler l'expression des gènes et induire des changements phénotypiques. Le grand nombre d'études portant sur les petits ARN interférents (siARN), les ARN en épingle à cheveux courts (shARN), les microARN (miARN) (Zhang et al., 2007 ; Huang et al., 2008) et d'autres banques de petits ARN réalisées chez diverses espèces et dans différents types cellulaires, y compris chez l'humain, offre une feuille de route potentielle des séquences susceptibles d'entraîner des états pathologiques ou de moduler les mécanismes de défense contre les maladies.
L'une des raisons pour lesquelles l'administration d'ARN représente une menace biologique potentielle réside dans le fait que même une légère perturbation initiale de l'expression génique (telle que les modifications d'expression généralement induites par les microARN) pourrait considérablement altérer la probabilité d'une première modification cellulaire. Même de faibles quantités d'ARN ciblé ne modifieraient pas le génome en tant que tel, mais pourraient permettre ou encourager les cellules à amorcer un processus d'autotransformation tumorale, comme en témoigne le grand nombre de microARN pro-oncogènes déjà découverts (O'Bryan et al., 2017). Outre les ARN produits par les virus, les bactéries produisent de nombreux petits ARN régulateurs ; leur introduction dans le microbiome endogène pourrait induire une dysbiose. Les ARNm de grande taille peuvent également être administrés via des liposomes et des nanoparticules ou par des stratégies de réplication de l'ARN actuellement développées pour la production de vaccins (voir le chapitre 8, « Développement rapide de vaccins à ARNm auto-amplificateurs ») ; ces méthodes pourraient potentiellement être utilisées pour exprimer des charges délétères telles que des toxines ou des oncogènes, à l'instar des menaces liées aux vecteurs d'ADN.
Il est clair que des séquences d'ARN, petites ou grandes, peuvent être introduites dans le corps humain à des fins malveillantes, notamment pour favoriser le développement de cancers, la dysbiose, la suppression du système immunitaire et des lésions organiques. Ceci peut se faire avec ou sans incorporation du code ARN pathogène dans le génome de l'hôte, et même par des séquences d'ARN qui n'ont pas besoin de coder de protéine.
De plus, ce même manuel indique que les plateformes vaccinales sont reconnues comme un vecteur potentiel d'armement :
« Les ARNm de plus grande taille peuvent également être véhiculés par des liposomes et des nanoparticules ou par des stratégies de réplication de l’ARN actuellement développées pour la production de vaccins [en référence à la plateforme de vaccin à ARNm auto-amplificateur] … ces méthodes pourraient potentiellement être utilisées pour exprimer des charges nocives telles que des toxines ou des oncogènes. »
Par conséquent, les produits à ARNm/ADN commercialisés comme « vaccins » sont, en principe, susceptibles d’être falsifiés, que ce soit intentionnellement ou en raison d’un manque de contrôles adéquats du processus de fabrication et de caractérisation de leur pureté. Les capacités techniques requises pour caractériser et contrôler de manière fiable ces substances au moment de leur fabrication, de leur distribution et de leur administration sont encore balbutiantes et n’étaient ni systématiquement mises en place par les fabricants ni par les autorités réglementaires en 2020-2021, lors du déploiement massif de ces substances à l’échelle mondiale.
2.
« Appât et substitution » : les consommateurs du monde entier ont été
induits en erreur quant au statut juridique des produits Covid-19 en
tant que contre-mesures – médicaments utilisés à des fins non médicales,
c’est-à-dire comme armes.
2.1.
Résumé des exigences légales en vertu du droit américain et du droit de
l’UE pour la commercialisation des produits pharmaceutiques comme étant
« sûrs et efficaces ».
Aux États-Unis comme dans l'Union européenne, la réglementation pharmaceutique vise à garantir la sécurité, l'efficacité et la qualité des médicaments avant leur mise sur le marché. Bien que les systèmes américain et européen présentent de nombreuses similitudes, notamment leur recours aux données scientifiques, chacun dispose de ses propres organismes de réglementation et procédures d'évaluation des médicaments et d'approbation des allégations relatives à leur sécurité et à leur efficacité.
Aux États-Unis, la Food and Drug Administration (FDA), par l'intermédiaire de son Centre d'évaluation et de recherche sur les médicaments (CDER) et de son Centre d'évaluation et de recherche sur les produits biologiques (CBER), est la principale autorité chargée d'approuver les produits pharmaceutiques. Avant la commercialisation d'un nouveau médicament, le promoteur doit soumettre une demande d'autorisation de mise sur le marché (AMM) ou une demande d'autorisation de mise sur le marché d'un produit biologique (BLA) comprenant des données solides issues d'études précliniques et d'essais cliniques démontrant l'innocuité et l'efficacité du produit pour l'usage auquel il est destiné. Le processus d'essais cliniques requiert le statut d'essai expérimental du produit au titre d'une exemption pour médicament expérimental et suit une progression structurée à travers les phases I à III, sous la supervision formelle d'un comité d'éthique de la recherche (CER) indépendant, garantissant la protection des participants et la mise en œuvre de procédures de consentement éclairé valides. Ce n'est qu'après ce processus rigoureux, aboutissant à une évaluation favorable du rapport bénéfice-risque, que des allégations d'innocuité et d'efficacité peuvent être formulées. La FDA examine également la conformité du fabricant aux bonnes pratiques de fabrication et cliniques (BPF) en vigueur, garantissant ainsi la fidélité du produit aux quantités précises d'ingrédients et à l'étiquetage afin de s'assurer que toutes les allégations sont fondées et non trompeuses.
Au sein de l'Union européenne, le cadre réglementaire est régi par l'Agence européenne des médicaments (EMA) pour les autorisations centralisées, tandis que les autorités nationales compétentes (telles que l'Institut fédéral allemand des médicaments et des dispositifs médicaux (BfArM), l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) en France ou le CBG/MEB aux Pays-Bas) gèrent les procédures décentralisées ou de reconnaissance mutuelle. Pour la plupart des médicaments innovants, notamment ceux issus des biotechnologies ou concernant plusieurs États membres de l'UE, la procédure centralisée est obligatoire. Celle-ci implique le dépôt d'une demande d'autorisation de mise sur le marché (AMM), qui doit contenir des données exhaustives similaires à celles exigées par la FDA, incluant des données cliniques et non cliniques. Les allégations de sécurité et d'efficacité sont examinées par le Comité des médicaments à usage humain (CHMP) de l'EMA avant qu'un avis ne soit émis et que l'autorisation ne soit accordée par la Commission européenne.
Dans les deux juridictions, la surveillance post-commercialisation est essentielle. Les entreprises sont tenues de mener des activités de pharmacovigilance et peuvent être amenées à réaliser des études complémentaires (essais de phase IV) afin de surveiller l'innocuité et l'efficacité à long terme. Tout support promotionnel ou publicitaire doit impérativement respecter l'étiquetage et les allégations approuvés ; toute allégation non fondée ou trompeuse peut entraîner des sanctions réglementaires. Par ailleurs, des exigences strictes en matière de transparence s'appliquent, notamment la publication des données des essais cliniques.
Bien que les systèmes américain et européen aient des structures et des processus réglementaires distincts, il existe une harmonisation importante grâce à des initiatives internationales, telles que le Conseil international pour l’harmonisation des exigences techniques relatives aux produits pharmaceutiques à usage humain (ICH) et les accords de reconnaissance mutuelle (abordés plus en détail dans ce témoignage).
L'autorité de réglementation pharmaceutique aux Pays-Bas est le Conseil d'évaluation des médicaments (CBG/MEB). Le CBG est chargé d'évaluer et de contrôler la sécurité, l'efficacité et la qualité des médicaments à usage humain et vétérinaire aux Pays-Bas. Il évalue les demandes d'autorisation de mise sur le marché (AMM) des nouveaux médicaments et veille à ce que les informations et les allégations relatives aux produits soient exactes, fondées sur des preuves et conformes aux exigences réglementaires. Cet organisme participe également au réseau réglementaire européen et travaille en étroite collaboration avec l'Agence européenne des médicaments (EMA) et les autres autorités nationales de l'UE.
Les responsabilités de CBG comprennent :
Octroi des autorisations nationales de mise sur le marché des médicaments aux Pays-Bas.
Participer aux procédures décentralisées et de reconnaissance mutuelle des autorisations de mise sur le marché des médicaments au sein de l'UE.
Contribuer aux procédures centralisées de l'EMA, notamment en participant aux évaluations scientifiques par le biais d'experts au sein de comités tels que le CHMP.
Assurer la surveillance de la pharmacovigilance et veiller à ce que les médicaments restent sûrs et efficaces après leur autorisation de mise sur le marché.
Le CBG opère sous l'égide du ministère néerlandais de la Santé, du Bien-être et des Sports et collabore avec l'Inspection de la santé et de la jeunesse (IGJ), qui veille au respect des lois pharmaceutiques et inspecte les fabricants et les prestataires de soins de santé.
2.2. Accords de reconnaissance mutuelle entre la FDA américaine et l'EMA européenne :
Les actions de la FDA américaine sont directement liées à celles de l'EMA en raison des accords de reconnaissance mutuelle signés par les autorités nationales de réglementation des produits alimentaires et pharmaceutiques dans les années précédant 2020. Ces accords sont des contrats permettant à une autorité de réglementation d'accepter, sans examen supplémentaire, les données qu'une autre autorité de réglementation, dans un pays ou une région différent, a prétendument examinées et approuvées. Ce cadre juridique a été créé pour promouvoir l'harmonisation et l'efficacité. Cependant, lors de la pandémie mondiale de COVID-19, orchestrée de manière malveillante, cette structure a été exploitée par les responsables, permettant ainsi à la FDA de simuler une réglementation et autorisant d'autres agences de réglementation à accepter ses déclarations sans procéder à des examens indépendants obligatoires des données.
Voici un exemple d'accord de reconnaissance mutuelle (ARM) entre la FDA et l'EMA. [8] Cet ARM États-Unis-UE est entré en vigueur le 1er novembre 2017 pour les médicaments à usage humain et le 30 mai 2023 pour les produits vétérinaires. Il est pleinement opérationnel pour les médicaments à usage humain depuis le 11 juillet 2019.
« Les personnes qualifiées dans les États membres de l’UE n’ont pas besoin de procéder à des tests par lots pour les médicaments à usage humain couverts par l’ARM, à condition qu’elles aient vérifié que ces contrôles ont été effectués aux États-Unis pour les produits fabriqués et importés des États-Unis. »
La plupart, sinon la totalité, des autres systèmes nationaux de réglementation des aliments et des médicaments s'appuient désormais sur la réglementation de la FDA et son contrôle de conformité/BPF, sans effectuer leurs propres examens, réglementations, tests par lots ou autres procédures BPF.
2.3.
Les injections d’ARNm contre le Covid-19 ont été déployées comme
contre-mesures médicales, alors qu’elles étaient faussement présentées
au public comme des produits pharmaceutiques normalement réglementés.
Alors que les injections d'ARNm contre la Covid-19 ont été largement commercialisées comme des « vaccins sûrs et efficaces », tous les produits et protocoles liés à la Covid-19 ont été mis sur le marché mondial sans respecter les normes de conformité habituelles en matière de fabrication et de distribution pharmaceutiques, du fait de leur statut juridique de « contre-mesures dans le cadre d'une urgence de santé publique ». Autrement dit, ils sont considérés comme non médicaux. Ce statut est régi par un cadre de gouvernance militarisé totalement différent et par un ensemble de lois distinct, initialement conçu pour répondre à des attaques ciblées, dans le temps et l'espace, impliquant des armes chimiques, biologiques, radiologiques et nucléaires (CBRN). Les accusés en étaient conscients. Le public n'a pas été informé du véritable statut juridique de ces injections ni de leur utilisation autorisée.
La FDA américaine donne la définition suivante des contre-mesures médicales :
« Les contre-mesures médicales (CMM) sont des produits réglementés par la FDA tels que des produits biologiques, des médicaments et des dispositifs qui peuvent être utilisés dans les situations d’urgence de santé publique pour diagnostiquer, prévenir ou traiter des maladies ou des affections causées par des menaces CBRN ou des maladies infectieuses émergentes. » [9]
Bien que le site web de la FDA affirme que les MCM sont « réglementés par la FDA », cette affirmation est trompeuse car elle omet le fait que les MCM ne sont pas réglementés comme les produits pharmaceutiques classiques, contrairement aux attentes des consommateurs et des professionnels de la santé.
En vertu du droit fédéral américain et du droit de l'UE, pour les usages médicinaux des médicaments, la FDA/EMA doit approuver formellement tout nouveau médicament expérimental avant qu'un fabricant puisse le mettre sur le marché interétatique.
Ce processus exige que le fabricant soumette une demande d'autorisation de mise sur le marché d'un nouveau médicament expérimental et obtienne l'approbation de la FDA/EMA pour son utilisation dans le cadre d'essais cliniques réglementés. Ce processus réglementé est donc qualifié de voie d'autorisation « expérimentale ». Il impose au fabricant de mener des essais cliniques réglementés, d'obtenir l'approbation d'un comité d'éthique de la recherche (CER) pour les protocoles d'essais cliniques, de garantir un suivi indépendant de la sécurité et d'obtenir le consentement éclairé des volontaires participant aux essais cliniques. De plus, la fabrication des médicaments et des produits biologiques ayant le statut d'essai expérimental doit être strictement conforme aux Bonnes Pratiques de Fabrication (BPF) en vigueur et aux réglementations plus générales relatives aux Bonnes Pratiques de Fabrication (BPF).
Les contre-mesures médicales (CM) peuvent inclure à la fois des produits médicaux déjà approuvés par la FDA/EMA (par exemple, des opioïdes, des respirateurs, des antibiotiques, des masques, des écouvillons, etc.) et de nouveaux produits non approuvés (par exemple, des injections d'ARNm/ADN). Cependant, la principale distinction entre les CM et les médicaments normalement réglementés réside dans la classification légale des CM comme n'étant pas expérimentales . Plus précisément, en droit américain, l'utilisation de contre-mesures couvertes par une autorisation d'utilisation d'urgence (AUU) dans le cadre d'une urgence de santé publique déclarée ne constitue pas une investigation clinique (21 USC 360bbb-3(k)). Par conséquent, l'innocuité et l'efficacité de ces contre-mesures ne peuvent être testées conformément à la législation américaine (21 CFR 312 et 21 CFR 601), et la FDA ne peut pas non plus garantir le respect des bonnes pratiques de fabrication (BPF) ou des bonnes pratiques de distribution (BPD) en vigueur.
Cette nouvelle catégorisation des dispositifs médicaux précédemment approuvés et non approuvés autorise leur utilisation à des fins non approuvées. Conjuguée à leur statut non expérimental, cette catégorisation empêche leur utilisation comme médicaments et, en supprimant les garanties pour les consommateurs, les rend totalement vulnérables à une utilisation à des fins invasives.
Les lois permettant la suppression de toutes les garanties offertes aux consommateurs et de la responsabilité des fabricants comprennent le PREP Act (2005) [10] , l'article 564 du Food, Drug and Cosmetics Act (FDCA) [11] aux États-Unis et un ensemble de dispositions de l'UE relatives à la « préparation aux pandémies » et aux « contre-mesures médicales » (abordées dans la section 2.5). Le PREP Act et les dispositions européennes correspondantes relatives aux contre-mesures dispensent de l'application du droit pharmaceutique aux produits déclarés contre-mesures en vertu d'une déclaration d'urgence existante et confèrent une immunité de responsabilité aux personnes concernées (sauf en cas de faute intentionnelle strictement définie). Le PREP Act fait l'objet de controverses juridiques et une proposition d'abrogation est actuellement en cours d'examen au Congrès américain [12] .
Du fait du statut non expérimental déclaré des contre-mesures médicales (MCM), bien que les fabricants puissent choisir et que la FDA/EMA puissent demander d'entreprendre certaines activités généralement attendues d'un essai clinique et d'un processus de validation de la fabrication, aucune des normes réglementaires pharmaceutiques habituelles n'est applicable de manière contraignante. En règle générale, toute activité présentée comme un essai ou un processus expérimental réglementé pour les contre-mesures médicales doit être considérée comme une pratique trompeuse visant à créer une illusion de protection du consommateur là où il n'y en a aucune, ni même l'intention d'en avoir une.
La FDA a le pouvoir discrétionnaire de délivrer une autorisation d'utilisation d'urgence (EUA) si, de l'avis exclusif du secrétaire à la Santé et aux Services sociaux (HHS), le produit « peut être efficace » dans le traitement de la maladie ou de l'affection concernée [13] . Aucun autre critère d'approbation n'est applicable. Il n'existe aucune obligation légale stricte de mener des essais cliniques avant l'autorisation et, compte tenu du statut légal « non expérimental » des contre-mesures, aucun essai clinique protégé contre la participation humaine n'est possible.
La FDA approuvera les contre-mesures dans le cadre d'une autorisation d'utilisation d'urgence (EUA) même en l'absence d'informations complètes, se fondant sur l'avis du secrétaire à la Santé et aux Services sociaux selon lequel les bénéfices connus et potentiels du produit pourraient l'emporter sur les risques connus et potentiels [14] et considère qu'il est peu probable que des données d'efficacité exhaustives soient disponibles avant l'octroi d'une EUA. En revanche, pour un médicament expérimental (dans le cadre de la procédure d'autorisation réglementaire normale), la FDA refusera l'autorisation si le demandeur ne démontre pas l'innocuité dudit médicament [15] .
L'obtention d'une autorisation d'essai clinique (IND) n'est pas strictement requise, de même que l'approbation d'un protocole d'essai clinique et des formulaires de consentement éclairé par un comité d'éthique de la recherche (CER). Par conséquent, le statut d'autorisation d'utilisation d'urgence (AUU) d'une contre-mesure médicale empêche la collecte des données d'essais cliniques réglementées et, de ce fait, l'acquisition de connaissances scientifiques fiables et valides sur les risques et les bénéfices associés à cette contre-mesure tant qu'elle demeure non expérimentale.
De plus, aucune norme n'est exigée en matière de contrôle de la qualité lors de la fabrication ; les procédures de fabrication ne font l'objet d'aucune inspection ; aucun test de validation des lots n'est effectué ; aucune interdiction de la variabilité entre les lots n'est imposée ; la falsification n'est pas interdite ; et le respect des Bonnes Pratiques de Fabrication actuelles n'est pas requis. Les produits EUA, même s'ils ne sont ni réglementés ni normalisés, « ne doivent pas être considérés comme falsifiés ou mal étiquetés » [16].
La procédure d’autorisation d’utilisation d’urgence (EUA) pour les contre-mesures médicales n’est utilisée que lorsque le secrétaire américain à la Santé et aux Services sociaux ou le ministre de la Santé d’un ou plusieurs États membres de l’UE déclare l’état d’urgence [17] . Aux États-Unis, les déclarations d’urgence du PREP Act relatives à la COVID-19 ont été prolongées à 12 reprises, jusqu’à fin 2029 [18] , empêchant ainsi l’adoption de réglementations contraignantes et prolongeant l’exonération de responsabilité pour les décès et les blessures causés par ces contre-mesures.
Aux Pays-Bas, le gouvernement a officiellement classé la COVID-19 comme maladie infectieuse de catégorie A en vertu de la loi nationale sur la santé publique (Wet publieke gezondheid) le 27 janvier 2020. Cette classification, annoncée par le ministre de la Santé Bruno Bruins, a déclenché une série de mesures d'urgence. Cette mesure équivaut de fait à une déclaration nationale d'urgence de santé publique, conférant aux autorités les pouvoirs conférés par la loi sur la santé publique. Ces pouvoirs ont permis des réponses à l'échelle nationale, telles que des confinements, sans qu'il soit nécessaire de déclarer formellement l'état d'urgence. Les Pays-Bas n'ayant jamais invoqué de déclaration nationale formelle d'« urgence de santé publique », il n'existe par conséquent aucun état d'urgence susceptible de prendre fin officiellement.
En résumé, aux États-Unis comme dans l'Union européenne, le statut juridique d'un produit, d'un service, d'une procédure ou d'une action désigné comme « contre-mesure » est équivalent à celui d'une arme potentielle. Les médicaments, ou médicaments potentiels (médicaments non autorisés), lorsqu'ils sont désignés comme « contre-mesures » dans le cadre d'une situation d'urgence réelle ou simulée, peuvent être utilisés à des fins non médicales. Ces fins non médicales incluent l'utilisation comme arme ou dans le cadre d'expérimentations humaines illégales. La loi applicable autorise les déclarations mensongères concernant l'innocuité, l'efficacité ou la composition des produits bénéficiant d'une autorisation d'utilisation d'urgence (EUA). Les accusés le savaient ou auraient dû le savoir, et pourtant ils l'ont dissimulé au public et ont propagé des mensonges monstrueux et exercé des pressions coercitives afin d'étendre au maximum le déploiement de ces prétendus médicaments, qui sont en réalité des armes biochimiques.
2.4. Dispositions juridiques relatives aux contre-mesures dans l’UE.
Bien que les lois pertinentes entre les États-Unis et l'UE ne soient pas identiques, plusieurs dispositions de l'UE correspondent aux dispositions américaines en matière de « contre-mesures médicales ».
Au sein de l'Union européenne (UE), les contre-mesures médicales sont principalement encadrées par la législation européenne relative aux produits pharmaceutiques, aux dispositifs médicaux et à la santé publique, notamment en ce qui concerne la préparation aux graves menaces sanitaires transfrontalières. Bien que l'UE n'utilise pas le terme « contre-mesure médicale » aussi explicitement que la FDA américaine, son cadre juridique soutient le développement, l'autorisation, le stockage et le déploiement de ces produits en cas d'urgence sanitaire.
Principales lois et réglementations de l'UE régissant les contre-mesures médicales :
1. Règlement (UE) 2022/2371 « relatif aux menaces transfrontières graves pour la santé »
Adopté : 2022
Établit :
Plan de préparation aux crises sanitaires et aux pandémies
Coordination des contre-mesures médicales au niveau de l'UE
L'Autorité de préparation et de réponse aux urgences sanitaires (HERA)
2. Règlement (UE) 2022/123 « relatif à un rôle renforcé de l’Agence européenne des médicaments (EMA) »
Adopté : janvier 2022
Objectif : Élargir le rôle de l'EMA dans la surveillance, la coordination et la facilitation du développement et de la disponibilité des médicaments et des dispositifs médicaux lors des urgences de santé publique.
Crée le Groupe de pilotage des pénuries de médicaments (MSSG) et le Groupe de travail d'urgence (ETF).
Base juridique des autorisations d'utilisation d'urgence des contre-mesures médicales dans l'UE.
Référence juridique : Règlement (UE) 2022/123
3. Accord d’achat groupé (AAG) au titre de l’article 5 de la décision 1082/2013/UE
Permet aux États membres de l'UE de se procurer conjointement des vaccins , des antiviraux , des EPI et d'autres contre-mesures médicales.
Toujours opérationnel en tant qu'outil d'approvisionnement coordonné après la COVID-19 dans le cadre du programme HERA.
4. En 2016, l’Union européenne a adopté le règlement (UE) 2016/369 ( https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32016R0369&from=EN ) qui prévoit une aide d’urgence au sein de l’Union européenne. Cette aide « peut être octroyée par le biais de mesures spécifiques adaptées à la situation économique en cas de catastrophe naturelle ou d’origine humaine , en cours ou potentielle » (art. 1, par. 1). Suite à une décision du Conseil, prise conformément à l’article 2 du règlement 2016/369/UE, « d’activer l’aide d’urgence » prévue par ce règlement, après proposition de la Commission européenne, les conditions sont réunies pour financer des « mesures spécifiques » face à la menace découlant de « catastrophes naturelles ou d’origine humaine ».
Le 14 avril 2020, ce règlement a été modifié par le règlement (UE) 2020/521 [19] avec effet rétroactif au 1er février 2020 , afin d’étendre l’application de ce règlement au soutien d’urgence pendant la crise de la Covid-19.
Son article 1 active le « soutien d’urgence prévu par le règlement (UE) 2016/369 du Conseil ».
Le présent règlement prévoit une annexe au règlement 2016/369/UE qui énumère les mesures éligibles pouvant être financées en cas de situation d'urgence. Il précise que cette énumération n'est pas exhaustive et se lit comme suit :
« Les actions suivantes peuvent être financées en cas de pandémie à grande échelle : »
(a) renforcement temporaire du personnel médical, échange de professionnels de la santé, accueil de patients étrangers ou autre type de soutien mutuel ;
b) le déploiement d’installations de soins de santé temporaires et l’extension temporaire des installations de soins de santé existantes afin de soulager la pression sur les structures existantes et d’accroître la capacité globale des soins de santé ;
(c) activités visant à soutenir l’administration de l’application à grande échelle des tests médicaux et à préparer les stratégies et protocoles de tests scientifiques nécessaires ;
d) la mise en place d’installations de quarantaine temporaires et d’autres mesures appropriées aux frontières de l’Union ;
e) développement, production ou achat et distribution de produits médicaux ;
(f) augmentations et conversions des capacités de production de produits médicaux visées au point (e) pour remédier aux pénuries d’approvisionnement ;
(g) la gestion des stocks de produits médicaux visés au point (e) et leur élimination ;
h)
les mesures visant à appuyer les démarches nécessaires pour obtenir
l’approbation de l’utilisation des produits médicaux visés au point
e), le cas échéant;
(i) des actions visant à élaborer des méthodes appropriées pour suivre l’évolution de la pandémie et les résultats des mesures
mises en œuvre pour y faire face ;
j) l’organisation d’essais cliniques ad hoc de thérapies ou de diagnostics potentiels selon des normes d’essais convenues au niveau de l’Union ;
(k) validation scientifique des produits médicaux, y compris les nouvelles méthodes d’essai potentielles.
La liste ci-dessus n'est pas exhaustive.
Ainsi, le point h) autorise toute action jugée nécessaire à l'obtention de l'autorisation d'utilisation des produits médicaux. Il permet de contourner les dispositions applicables aux médicaments et aux dispositifs médicaux.
Le (j) montre que pour les essais cliniques « ad hoc », les BPC (Bonnes Pratiques Cliniques/Bonnes Pratiques de Fabrication) peuvent être écartées et remplacées par des « normes d’essai définies de manière assez vague et convenues au niveau syndical », c’est-à-dire les règles convenues par des bureaucrates non élus, plutôt que les réglementations pharmaceutiques énoncées dans la loi qui régit la sécurité des consommateurs en matière de produits médicaux.
2.5.
La voie de l’autorisation de mise sur le marché conditionnelle (AMM)
dans l’UE a été utilisée pour administrer des contre-mesures sous
couvert de médicaments.
Des preuves accablantes de tromperie publique de la part de sociétés pharmaceutiques agissant de concert avec les autorités réglementaires ont été révélées fin novembre 2020, suite à la fuite d'environ 1 000 pages de documentation relative aux contrôles de fabrication et de chimie (CMC) et d'échanges de courriels internes de l'EMA [20] . L'intégralité des documents divulgués figure en annexe à la présente déclaration sous serment. Ces documents ont démontré que les responsables de la santé publique de l'Union européenne ont trompé tous les citoyens, en leur donnant l'impression d'avoir évalué et approuvé les vaccins contre la COVID-19 conformément aux normes en vigueur pour les médicaments, du moins sur la base des autorisations de mise sur le marché conditionnelles (AMM). Les documents ont révélé qu'en coulisses, les autorités réglementaires se préoccupaient uniquement du calendrier de lancement, avant même l'examen des données, et qu'elles ont assoupli ou considérablement réduit les normes de qualité pour aider Pfizer à les « respecter », sur la seule parole de Pfizer et sans aucun fondement scientifique. Cette manœuvre trompeuse a été coordonnée à l'échelle mondiale par les agences réglementaires : FDA, EMA, MHRA, TGA, Santé Canada et bien d'autres.
Au sein de l'UE, le même résultat – l'absence de toute application effective des réglementations cGxP pharmaceutiques et autres lois pharmaceutiques pertinentes – a été obtenu en contraignant tous les États membres à signer des contrats d'achat prédateurs, orchestrés par l'UE, avec des fabricants de produits pharmaceutiques. Ces contrats contournaient toutes les réglementations pharmaceutiques applicables et obligeaient les gouvernements nationaux à indemniser les fabricants en cas de poursuites fructueuses engagées contre les entreprises pharmaceutiques dans les États membres. Cette indemnisation incluait la renonciation à l'immunité souveraine (voir p. 32 de l'accord d'achat anticipé de Pfizer avec l'UE [21] ). De fait, ces contrats ont empêché les États membres d'exercer leur souveraineté législative en matière de responsabilité pharmaceutique pour ces produits sur leur territoire. Ces contrats auraient été négociés par Ursula von den Leyen par SMS. Une enquête du Parquet européen (EPPO) est en cours concernant l'acquisition des vaccins contre la COVID-19 dans l'Union européenne [22] . Les défendeurs, qui agissaient en tant qu'autorités sanitaires correspondantes aux Pays-Bas, savaient ou auraient dû savoir que ces clauses contractuelles étaient abusives, violaient la Constitution de l'État concerné et étaient donc inacceptables pour un gouvernement souverain, et qu'elles entraîneraient des préjudices massifs parmi les citoyens que ces responsables de la santé publique avaient juré de protéger.
L'un des principaux mécanismes de tromperie consistait à lier les 27 États membres de l'UE à un accord unique (aveugle) en promettant que les vaccins en Europe suivraient la procédure d'autorisation de mise sur le marché conditionnelle (AMM) plutôt que l'autorisation d'urgence, c'est-à-dire la question de l'article 5, paragraphe 2, contre l'AMM. Ce point est abordé dans plusieurs courriels figurant dans la documentation divulguée de l'EMA. Par exemple :
L’article 5, paragraphe 2, est un mécanisme d’autorisation d’urgence dont disposent individuellement les États membres. Cette autorisation est valable un an seulement, est délivrée par chaque État et peut être révoquée indépendamment par chacun d’eux. L’autorisation compassionnelle (AC) est un mécanisme paneuropéen sur lequel les États membres n’ont aucun pouvoir de décision. Dans l’UE, l’AC est toutefois une voie d’accès non urgente à des fins expérimentales qui, avant 2020, était réservée aux médicaments oncologiques dans le cadre d’un « droit d’essayer » ou d’un « usage compassionnel » pour les patients en phase terminale. Elle est similaire à l’autorisation d’accès élargi (EAU ) [23] (à ne pas confondre avec l’autorisation d’utilisation d’urgence [EUA]) aux États-Unis. Les deux procédures (AC et EAU) sont expérimentales, c’est-à-dire légalement désignées comme usage et finalité médicaux du produit. Cependant, comme indiqué précédemment, les « contre-mesures » sont des substances non expérimentales destinées à des fins non médicales. Les qualifier d’AC ou d’« autorisation compassionnelle » constitue donc une fraude et une tromperie liées à leur utilisation comme armes.
Comme le stipule la loi, la CMA semble constituer un mécanisme de réglementation et de conformité beaucoup plus efficace que l'article 5(2) :
La différence importante entre l'article 5(2) et la CMA réside dans le fait qu'elle fait peser la responsabilité sur le fabricant, et c'est ce qui devait être appliqué grâce à l'autorisation paneuropéenne de la CMA :
Cependant, dans une escroquerie classique de type « appât et substitution », les autorités de santé publique de l'UE et des Pays-Bas n'ont jamais eu l'intention de contraindre les entreprises pharmaceutiques à respecter les normes CMA promises. Les contrats d'approvisionnement de l'UE avec les entreprises pharmaceutiques ont levé l'ensemble des réglementations et lois relatives à la sécurité des consommateurs en vigueur dans leurs pays respectifs. De fait, cela a vidé de leur substance les normes CMA en matière de sécurité des consommateurs et de responsabilité des fabricants, car sans application, la loi est lettre morte !
Par exemple, voir l’accord d’approvisionnement de l’UE avec Pfizer [24] concernant l’indemnisation :
En résumé, l'effet net de la loi PREP (à savoir la suppression de toutes les réglementations pharmaceutiques pertinentes et de la responsabilité des fabricants) a été réalisé dans l'UE par la centralisation des accords d'approvisionnement dans le cadre du système frauduleux paneuropéen conçu pour transférer des contre-mesures militaires aux consommateurs sous couvert de vaccins autorisés par la CMA et ultérieurement « entièrement approuvés ».
2.6.
Preuve directe de la non-conformité des injections d'ARNm/ADN du covid
avec les réglementations pharmaceutiques normales attendues par les
consommateurs et les prestataires de soins de santé.
Environ 1 000 pages de documents de fabrication de Pfizer ont fuité de l'Agence européenne des médicaments (EMA) fin 2020, révélant l'absence de conformité aux Bonnes Pratiques de Fabrication (BPF) moins de deux semaines avant la mise sur le marché du produit auprès de milliards de consommateurs dans le monde. La fuite de ces documents a été authentifiée par le British Medical Journal . L'EMA n'a pas contesté leur authenticité. Outre ces documents de fabrication, les archives de l'EMA contiennent également 14 captures d'écran de courriels datant de mi-novembre à fin novembre 2020. Ces échanges de courriels concernent le personnel et la direction de l'EMA, ainsi que leurs correspondances avec la FDA et la MHRA (l'autorité de réglementation britannique). Ces courriels démontrent que les examinateurs de l'EMA subissaient d'énormes pressions politiques pour trouver de nouvelles méthodes d'approbation de produits intrinsèquement dangereux et non approuvables. Il ressort clairement des courriels, commentaires et objections soulevés par le personnel d'examen de l'EMA qu'ils n'étaient pas au courant du statut juridique des injections contre la Covid-19 en tant que contre-mesures, ni que l'examen réglementaire des données n'était pas essentiel à leur déploiement.
Il est également évident que la direction de l'EMA se préoccupait avant tout de coordonner les dates de lancement, et que l'« autorisation » de ces vaccins pour tous les États membres de l'UE était une évidence. La pression exercée pour fermer les yeux sur toutes les lacunes réglementaires venait des plus hautes sphères des gouvernements américain, britannique et européen.
Le personnel de l'EMA a été contraint d'approuver un produit présentant de graves problèmes de qualité, insolubles compte tenu des délais volontairement irréalistes. Le processus de fabrication était loin d'être conforme. Les examinateurs de l'EMA ont soulevé plus de 100 objections à l'approbation, dont plusieurs objections majeures. Ces objections majeures incluaient notamment :
1) absence de conformité aux BPFc ;
2) absence d’intégrité de l’ARNm et grandes quantités de fragments d’ARNm ( dont certains peuvent être caractérisés comme miRNA, siRNA et shRNA - tous des composants potentiels d’armement comme décrit ci-dessus ) ;
3) de nombreuses lacunes importantes dans la documentation de fabrication rendent impossible de déterminer si le produit pourrait être fabriqué comme décrit.
Des courriels divulgués par l'EMA démontrent également que les autorités réglementaires européennes ne s'intéressaient qu'aux dates de lancement des produits et n'avaient pas l'intention d'examiner les données nécessaires au préalable. Le processus était hautement politique et non scientifique. Les régulateurs de l'EMA se sont contentés d'assurances verbales de la part des responsables de la FDA au lieu d'analyser les données. Comme indiqué précédemment, les examinateurs de l'EMA ont émis des objections quant aux données, mais les hauts responsables ont ignoré et passé outre leurs préoccupations.
Le non-respect des BPF (Bonnes Pratiques de Fabrication) signifie qu'il est impossible de garantir que les produits contiennent des ingrédients spécifiques en quantités précises dans les unités dispensées aux patients. Par conséquent, outre le fait que le produit est dangereux, aucun consentement éclairé n'est possible.
L'un des éléments clés garantissant la qualité de la substance médicamenteuse est un cahier des charges fondé sur l'état actuel du développement du produit ainsi que sur les connaissances scientifiques et technologiques. À cet égard, le cadre est défini par la directive Q6A de la Conférence internationale sur l'harmonisation (ICH) intitulée « Procédures d'essai et critères d'acceptation pour les nouvelles substances médicamenteuses et les nouveaux médicaments : substances chimiques » [25] . Ce cahier des charges définit une liste d'essais, ainsi que des références aux procédures analytiques et aux critères d'acceptation appropriés pour l'évaluation de la qualité du produit concerné, notamment en ce qui concerne l'identité, le dosage/la quantité, la pureté/les impuretés et l'activité biologique.
Toutes les procédures analytiques doivent être entièrement validées. Cela signifie que des méthodes standard déjà validées doivent être utilisées, ou, si la méthode est exclusive ou nouvelle, le fabricant doit concevoir et valider intégralement les analyses utilisées. Ceci implique notamment des tests définitifs avec contrôles positifs et négatifs, ainsi qu'une documentation complète et traçable (« piste d'audit ») pour chaque test. Le secret commercial ne saurait justifier le non-respect de ces exigences. Même si le fabricant ne souhaite pas divulguer publiquement ses procédures analytiques, il doit néanmoins soumettre une documentation complète et transparente à la FDA, qui la conserve (et cette information est officiellement communiquée aux acheteurs du produit pour leur propre conformité aux BPF).
Dans la documentation CMC de Pfizer qui a fuité fin 2020, les examinateurs de l'EMA ont constaté l'absence de description des méthodes « non pharmacopéiques », c'est-à-dire des méthodes propriétaires développées par Pfizer pour ses procédures analytiques. De ce fait, il a été impossible d'évaluer la rigueur scientifique des méthodes propriétaires utilisées par Pfizer pour contrôler la qualité des injections produites.
De nombreux paramètres de contrôle des produits et des procédés étaient propriétaires, mal définis, certains n'avaient pas encore été inventés et aucun n'avait fait l'objet d'une validation scientifique. Par exemple, le test choisi pour l' identification de l'ARNm était la RT-PCR (PCR en temps réel). Or, l'ARNm est une substance très instable et fragile qui, malgré des manipulations et une « optimisation » chimique visant à améliorer sa stabilité, conserve une grande fragilité. De ce fait, l'intégrité de l'ARNm s'est avérée problématique, notamment lors du passage à l'échelle industrielle.
L'une des principales objections (OM) des examinateurs de l'EMA, mentionnée dans la documentation CMC de Pfizer qui a fuité, était le manque d'intégrité de l'ARNm, c'est-à-dire un faible pourcentage d'ARN dans le flacon conforme aux spécifications et un pourcentage très élevé de fragments d'ARN cassés :
La grande quantité d'ARN non conforme a été considérée comme une impureté par les examinateurs de l'EMA. Il s'agit, en effet, d'un problème majeur : l'efficacité revendiquée du produit reposerait entièrement sur le « code correct » permettant la production de la « protéine Spike de Wuhan » par les cellules des personnes injectées. Nous avons ici la preuve que les autorités réglementaires s'opposent à l'autorisation car de nombreux autres phénomènes, outre la production de la « protéine Spike de Wuhan », peuvent se produire dans les cellules bombardées de fragments d'ARN, une méthode de détournement connue des vaccins à ARNm, comme indiqué précédemment .
Au lieu de suspendre l'approbation et d'exiger que l'intégrité de l'ARNm soit vérifiée, les autorités réglementaires ont tout simplement arbitrairement modifié le critère d'acceptation du pourcentage d'intégrité de l'ARNm, le faisant passer de la norme précédente de plus de 70 % à un peu plus de 50 %.
Cela signifie qu’une grande partie de la substance médicamenteuse peut contenir des ARN « poubelle », des fragments et des séquences non caractérisées, dont certaines sont suffisamment grandes pour coder des protéines inconnues et potentiellement aberrantes, et la plupart appartiennent à la catégorie des micro-ARN (miARN). Ces courtes séquences, bien que non codantes, sont connues pour interférer avec les processus cellulaires et sont impliquées dans les voies de signalisation du cancer [26] .
Au final, l'examen réglementaire lui-même et les objections soulevées par les examinateurs de l'EMA n'avaient aucune importance : le produit allait être mis sur le marché malgré les objections réglementaires en raison de la riposte militaire CBRN déclenchée à l'échelle mondiale, à l'insu du public.
2.7. Suppression des exigences relatives aux inspections des installations de fabrication de produits biologiques :
Ni la FDA ni l'EMA n'ont procédé aux inspections des sites de production de Pfizer et de ses fournisseurs en 2020, invoquant l'urgence sanitaire liée à la COVID-19. Lors de la reprise des inspections en 2022, le principal sous-traitant européen de Pfizer, Rentschler, a été reconnu coupable d'infraction aux BPF (formulaire 483 émis). Par conséquent, la chaîne d'approvisionnement de Pfizer en Europe n'était pas conforme entre 2020 et 2022. Aucune mesure coercitive n'a été prise par les autorités réglementaires, la législation relative aux autorisations d'utilisation d'urgence (EUA) ne permettant aucune sanction.
Il convient également de noter qu'en 2019, manifestement en prévision de la pandémie de Covid-19, le commissaire de la FDA de l'époque, Scott Gottlieb, a modifié la réglementation fédérale régissant l'inspection des établissements agréés fabriquant tous les produits biologiques, y compris les vaccins. La fréquence des inspections est passée d'au moins tous les deux ans à une fréquence indéterminée ; les dispositions coercitives en cas d'échec d'une inspection ont été supprimées ; et toutes les missions d'inspection ont été retirées aux inspecteurs de la FDA. Avant cette modification, l'article 600.21 du titre 21 du CFR, relatif à la fréquence des inspections, stipulait :
« L’inspection d’un établissement pour lequel une demande d’autorisation de mise sur le marché de produits biologiques est en cours n’a pas besoin d’être effectuée tant que l’établissement n’est pas en activité et ne fabrique pas le produit complet pour lequel une autorisation de mise sur le marché de produits biologiques est demandée. »
En cas de refus de la licence suite à l'inspection initiale, aucune nouvelle inspection ne sera effectuée tant qu'il n'aura pas été confirmé que les anomalies ayant motivé le refus ont été corrigées. Chaque établissement titulaire d'une licence et ses succursales feront l'objet d'une inspection au moins une fois tous les deux ans. Les inspections peuvent être réalisées avec ou sans préavis et auront lieu pendant les heures d'ouverture habituelles, sauf indication contraire.
À compter du 2 mai 2019, les trois dernières phrases du 21 CFR 600.21 ont été supprimées.
Il n'existe actuellement aucune obligation légale concernant une inspection initiale de la FDA ; aucun intervalle minimal pour les inspections ultérieures de la FDA, et aucune conséquence juridique n'est prévue en cas de non-conformité, telle que le refus ou la révocation de l'autorisation d'établissement ou de produit.
Les mécanismes juridiques par lesquels la réglementation de la FDA sur la fabrication de produits biologiques a disparu comprenaient une règle finale directe et une règle proposée, publiées simultanément par avis du Federal Register le 26 février 2018, et une règle finale du 2 avril 2019, publiée par le commissaire de la FDA de l'époque, Scott Gottlieb.
2.8. Reclassement arbitraire des thérapies géniques à ARNm/ADN en tant que « vaccins contre la Covid-19 » :
Concernant la plateforme technologique elle-même (ARNm dans des nanoparticules lipidiques [LNP] ou ADN dans un vecteur adénoviral), les deux sont connues sous le nom de technologies de « transfection ». L’objectif de la conception du produit est d’introduire diverses molécules biochimiques à l’intérieur des membranes cellulaires, et souvent dans le noyau de la cellule où se trouve l’ADN. Les méthodes de transfection utilisant une grande variété de technologies d’ARN et d’ADN sont une réalité scientifique bien établie. Par exemple, comme indiqué dans cet article de synthèse bibliographique [27] :
Une recherche bibliographique systématique, basée sur les recommandations PRISMA ( Moher et al., 2009 ), a été menée afin d'identifier les études ou protocoles publiés pertinents correspondant au champ d'application de cette revue ( Fig. 1 ). Les bases de données utilisées pour cette recherche étaient Scopus, Google Scholar et PubMed. Les mots-clés employés incluaient « transfection », « co-transfection », « produits chimiques », « réactifs », « ADN », « siRNA », « shRNA », « miRNA », « plasmide », « oligonucléotides » , « efficacité », « innocuité », « cytotoxicité », « contrôles » et d'autres termes clés associés. Une première recherche a permis d'identifier environ 5 000 articles, protocoles publiés ou manuels issus de diverses bases de données, décrivant ou comparant différentes méthodes de transfection, types d'acides nucléiques transfectés, contrôles de transfection, méthodes d'évaluation de l'efficacité de la transfection et réactifs de transfection .
La conception des produits de thérapie génique est identique à celle des « vaccins » contre la COVID-19 : les LNP acheminent le matériel génétique auquel elles sont fixées à l’intérieur des cellules, c’est-à-dire qu’elles les transfectent . La plateforme LNP et la plateforme adénovirale ne sont que deux types différents de vecteurs, les LNP étant particulièrement efficaces pour pénétrer dans les cellules. Le fait qu’il s’agisse d’une technologie de transfection est largement documenté dans la littérature scientifique et les documents réglementaires. Moderna et BioNTech ont toutes deux qualifié leurs technologies d’ARNm d’expérimentales, de « thérapie » et en phase de développement précoce dans leurs documents déposés auprès de la SEC juste avant la pandémie. Le formulaire 10-K de Moderna de 2019 précisait : « Les médicaments à ARNm constituent une approche nouvelle et non éprouvée… Aucune immunothérapie à ARNm n’a été approuvée et il est possible qu’aucune ne le soit jamais. »
Aucun médicament à base d'ARNm n'avait été approuvé par les autorités réglementaires du monde entier avant 2020. Ceci était dû à de nombreux manquements aux normes de sécurité et de conformité pharmaceutiques. Tous les produits en développement se sont heurtés à des problèmes de sécurité récurrents et n'ont même pas pu atteindre la première phase des essais cliniques [28] , [29] .
3.
Les injections d’ARNm contre le Covid-19 ont été financées, développées
et déployées dans le monde entier via une campagne militaire coordonnée
par des alliances militaires et de sécurité.
3.1. La Covid-19 n’était pas un événement de santé publique, mais une opération militaire mondiale :
L'opération Covid n'était pas un événement de santé publique, bien qu'elle ait été présentée comme telle à la population mondiale. Il s'agissait d'une opération mondiale, coordonnée par des alliances de renseignement et militaires publiques et privées, et invoquant des lois conçues pour les attaques aux armes CBRN (chimiques, biologiques, radiologiques et nucléaires).
Aux États-Unis, c'est le Conseil national de sécurité (et non le département de la Santé et des Services sociaux) qui est responsable de la politique de lutte contre la Covid-19. Dans d'autres pays du monde, la campagne contre la Covid-19 a été coordonnée par des mécanismes identiques : les forces armées et les services de renseignement ont piloté la riposte (comme en temps de guerre), tandis que les agences de santé publique ont simulé une urgence sanitaire auprès du public. Voir l'annexe 1 pour des preuves détaillées de cette campagne militaire mondiale, notamment concernant les Pays-Bas et d'autres pays de l'UE.
Aux États-Unis, le 13 mars 2020 : le « Plan de réponse adapté du gouvernement américain à la COVID-19 » (PanCAP-A) stipule que la politique américaine en réponse au SARS-CoV-2 n’est pas définie par les agences de santé publique désignées dans les protocoles de préparation aux pandémies (Loi sur la préparation aux pandémies et aux risques divers, [30] PPD-44, [31] BIA), mais par le Conseil national de sécurité (NSC). Le NSC ne réunit pas régulièrement de représentants des agences de santé publique et se concentre sur les questions de sécurité nationale et de politique étrangère.
Ci-dessous figure l'organigramme tiré du document PanCAP-A, p.9 :
3.2. Structure organisationnelle de l'opération Warp Speed
D’après les rapports de l’opération Warp Speed/ASPR, cette opération a été présentée comme un effort « collaboratif » du département de la Défense (DOD) et du département de la Santé et des Services sociaux (HHS) visant à produire des vaccins et des traitements « sûrs et efficaces » contre la COVID-19. Cependant, selon l’organigramme, le DOD occupait officiellement le poste de directeur des opérations, tandis que le HHS occupait celui de conseiller scientifique en chef. [32]
VRBPAC-10.22.20-Meeting-Presentation-COVID19-Vaccine-Development-Portfolio.pdf
Il convient de noter que le niveau hiérarchique immédiatement supérieur est contrôlé par le gouvernement américain et englobe toutes les fonctions de supervision liées à la production, la conception et la mise en œuvre des essais cliniques, la planification et l'analyse des opérations, la distribution, les relations publiques, la passation de marchés, les affaires juridiques et autres. Les entreprises pharmaceutiques se situent au troisième niveau hiérarchique.
Un rapport de STAT News publié en 2020 a révélé qu'une soixantaine d'officiers militaires, dont quatre généraux, étaient impliqués dans la direction de l'opération Warp Speed, nombre d'entre eux n'ayant aucune expérience préalable dans le domaine de la santé. Sur la centaine de postes de direction figurant dans l'organigramme, seuls 29 n'étaient pas occupés par des fonctionnaires du département de la Défense. [33]
Les documents non classifiés d'octobre 2020 provenant des présentations de l'opération Warp Speed au comité consultatif sur les vaccins et les produits biologiques connexes de la FDA révèlent le contrôle du gouvernement américain sur la quasi-totalité des aspects de conception et de mise en œuvre des contre-mesures contre la Covid [34] .
3.3. Examen des contrats DoD/BARDA relatifs aux contre-mesures contre la COVID
Des centaines de contrats relatifs aux contre-mesures contre la Covid-19 ont été rendus accessibles via des demandes d'accès à l'information (FOIA), sous forme partiellement expurgée. [35] L'examen de ces contrats révèle un contrôle important exercé par le gouvernement américain (Département de la Défense/BARDA) et limite les livrables à de simples « démonstrations » et « prototypes ». Or, une démonstration est une activité purement formelle. Les médicaments administrés à des personnes ne peuvent être considérés comme des « démonstrations et prototypes », contrairement aux armes qui peuvent être commandées en tant que prototypes. Ces contrats prévoient également l'exonération de toute responsabilité des fabricants et de tous les sous-traitants de la chaîne d'approvisionnement et de distribution, en vertu de la loi PREP de 2005 et de la législation fédérale connexe.
Bien que les contrats de contre-mesures du DoD/BARDA fassent référence aux exigences de sécurité et d'efficacité des vaccins et mentionnent la conformité aux bonnes pratiques de fabrication actuelles (BPF), ces éléments sont explicitement exclus du paiement (ou de la commande) par le gouvernement américain.
Les contrats ont été structurés selon l'autorité de transactions autres (OTA), une méthode de passation de marchés utilisée par le département de la Défense et la BARDA pour toutes les contre-mesures liées à la COVID-19 commandées auprès du secteur privé. Cette méthode permet aux agences fédérales de commander des produits normalement réglementés en contournant ces réglementations, ainsi que les mécanismes de responsabilité financière qui encadrent les marchés publics classiques et d'autres lois régissant la divulgation et la propriété intellectuelle (PI) issues de la recherche financée par des fonds publics. [36]
« Autre » est une catégorie fourre-tout qui ne correspond ni à un contrat, ni à une subvention de recherche, ni à un marché public, etc. : il ne s’agit d’aucun contrat public normalement réglementé/soumis à contrôle.
Le ministère de la Défense a utilisé l'OTA pour commander des « prototypes » et des « démonstrations » définis de manière vague qui ne sont pas soumis à un examen réglementaire.
Le propre rapport de la BARDA qualifie les produits contre la Covid-19 de « démonstrations » ou, au mieux, de « production à grande échelle » :
3.4. Contre-mesures du DoD/BARDA produites par un réseau établi d'entrepreneurs de défense
Les contrats du DoD/BARDA relatifs aux « contre-mesures » sont gérés par Advanced Technology International (ATI). [37] ATI gère principalement des consortiums de R&D pour le compte du Département de la Défense, notamment dans les domaines de la fabrication d'armements, de la fonderie et du forgeage de métaux, de la construction navale et des technologies visant à « contrer les armes de destruction massive (ADM) ». Deux de ces consortiums étaient liés à des projets biomédicaux.
Le Consortium des entreprises de technologies médicales (MTEC), qui opère pour le compte du Commandement de la recherche et du développement médical de l'armée américaine, développe des technologies de modification génétique, de nanotechnologie, de télémédecine, de prothèses et d'implants cérébraux. Le MTEC travaille actuellement à la mise au point d'un dispositif portable permettant de diagnostiquer la Covid-19 avant l'apparition des symptômes.
Le Consortium de défense médicale CBRN (MCDC) [38] comprend actuellement plus de 300 grandes et petites entreprises et entités académiques qui « soutiennent les besoins médicaux, pharmaceutiques et diagnostiques du Département de la Défense (DoD) pour contrer les agents de menace chimiques, biologiques, radiologiques et nucléaires (CBRN) » et permettent « des technologies prototypes pour des contre-mesures médicales thérapeutiques ciblant des cibles de toxines virales, bactériennes et biologiques d'intérêt pour le DoD », y compris le développement de vaccins.
Par le biais du mécanisme d’autorisation des autres transactions, le MCDC a passé des contrats avec des centaines d’entreprises pour fournir des « contre-mesures » liées à la Covid-19. Des doses de Pfizer ont été commandées le 20 juillet 2020, dans le cadre de l’accord de base conclu entre Advanced Technologies Inc (ATI, une société de gestion des fournisseurs du DOD) et Pfizer, Inc., identifié comme l’accord de base MCDC n° 2020-532 :
· 21 juillet 2020, Lettre de direction technique ou énoncé des travaux (SOW) du MCDC pour « Pandémie de COVID-19 - Démonstration de fabrication de vaccins à grande échelle » entre Pfizer et DOD/Advanced Technologies Inc. [39]
Les contrats stipulaient que le produit serait expédié au Département de la Défense (DoD), seul acheteur. Le produit livré n'est pas sérialisé : les doses unitaires n'ont pas de codes-barres et ne sont donc pas traçables selon les règles habituelles de distribution pharmaceutique, lesquelles visent à signaler tout problème de sécurité ou de qualité dans la chaîne d'approvisionnement. Le produit est ainsi exposé à la falsification, au mauvais étiquetage et à la falsification. Il a été expédié au DoD et traité par un système de distribution opaque, officiellement en raison des exigences de conservation au froid, lesquelles ont été ultérieurement levées. Toutefois, les pratiques de distribution via des entreprises et des contrats militaires sont restées inchangées.
Le produit est désigné comme « propriété du gouvernement américain » [40] jusqu’à son injection. Toute personne participant à la fabrication, à la chaîne d’approvisionnement, à la distribution et à l’administration du vaccin est considérée comme « personne protégée » par la loi PREP, pour autant qu’elle exécute les ordres du gouvernement américain. Quel que soit leur lieu de travail, elles sont considérées comme des employés du gouvernement américain dans le cadre de cette activité.
Il est important de noter que les contrats du ministère de la Défense décrivent les contre-mesures contre la Covid comme étant destinées à une « application civile et militaire ».
4. Conclusions et avis d'experts :
Sur la base de mon examen des documents réglementaires primaires, des fichiers de contrôle de la chimie, de la fabrication et de la production (CMC) de Pfizer qui ont fuité, de la législation pertinente aux États-Unis et dans l'UE, et d'autres documents accessibles au public, je suis d'avis, en tant qu'expert, que les injections d'ARNm contre la Covid-19 ont été déployées en vertu de règles militaires de « contre-mesures médicales » qui ont contourné les garanties pharmaceutiques standard, les rendant juridiquement et fonctionnellement indiscernables d'armes biochimiques potentielles.
Les injections contre la Covid-19 ont été présentées de manière trompeuse au public sous couvert de médicaments, faussement annoncées comme des « vaccins sûrs et efficaces ».
Les personnes qui ont prescrit, acheté et/ou administré les injections de Covid-19 (ARNm) ont participé à des crimes de guerre et/ou à un génocide (démocide).
Références et sources :
[1] https://en.m.wikipedia.org/wiki/List_of_U.S._biological_weapons_topics
[2] https://www.ncbi.nlm.nih.gov/books/NBK535870/
[3] https://sites.dartmouth.edu/dujs/2013/03/10/genetically-engineered-bioweapons-a-new-breed-of-weapons-for-modern-warfare/
[4] https://www.ncbi.nlm.nih.gov/books/NBK535887/
[5] https://irp.fas.org/threat/cbw/nextgen.pdf
[6] https://isgp-studies.com/jason-group-national-security-science
[7] https://www.ncbi.nlm.nih.gov/books/NBK535870/
[8] https://www.ema.europa.eu/en/human-regulatory-overview/research-and-development/compliance-research-and-development/good-manufacturing-practice/mutual-recognition-agreements-mra
[9] https://www.fda.gov/emergency-preparedness-and-response/about-mcmi/medical-countermeasures
[10] https://aspr.hhs.gov/legal/PREPact/pages/default.aspx
[11] https://www.fda.gov/regulatory-information/federal-food-drug-and-cosmetic-act-fdc-act/fdc-act-chapter-v-drugs-and-devices
[12] https://massie.house.gov/news/documentsingle.aspx?DocumentID=395737
[13] 21 USC § 360bbb-3(c)(2)(A)
[14] 21 USC § 360bbb3(c)(2)(B)
[15] 21 USC § 355(d)(2); Voir aussi 42 USC § 262(a)(2)(RB) (produit biologique approuvé uniquement s’il est réellement « sûr »).
[16] 21 USC 360bbb-3a(c).
[17] 21 USC § 360bbb-3(a)(1), (b).
[18] https://public-inspection.federalregister.gov/2024-29108.pdf
[19] https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32020R0521&from=EN
[20] https://www.bmj.com/content/372/bmj.n627
[21] https://dn721909.ca.archive.org/0/items/contract_03/Contract%203_text.pdf
[22] https://www.eppo.europa.eu/en/media/news/ongoing-eppo-investigation-acquisition-covid-19-vaccines-eu
[23] https://www.fda.gov/news-events/public-health-focus/expanded-access
[24] https://dn721909.ca.archive.org/0/items/contract_03/Contract%203_text.pdf
[25] https://www.fda.gov/regulatory-information/search-fda-guidance-documents/q6a-specifications-test-procedures-and-acceptance-criteria-new-drug-substances-and-new-drug-products
[26] https://www.nature.com/articles/sigtrans20154
[27] https://pmc.ncbi.nlm.nih.gov/articles/PMC8067914/
[28] https://www.statnews.com/2017/01/10/moderna-trouble-mrna/
[29] https://thewashingtonstandard.com/moderna-a-company-in-need-of-a-hail-mary/
[30] https://www.govinfo.gov/content/pkg/PLAW-109publ417/pdf/PLAW-109publ417.pdf
[31] https://www.in.gov/dhs/files/FEMA-Fact-Sheet-COVID-Response-3.4.20.pdf
[32] Voir « VRBPAC-10.22.20-Meeting-Presentation-COVID19-Vaccine-Development-Portfolio.pdf » en annexe
[33] https://www.statnews.com/pharmalot/2020/09/28/pharmalittle-operation-warp-speed-is-more-army-than-science-jjs-covid-19-vaccine-moves-forward/
[34] Voir « VRBPAC-10.22.20-Meeting-Presentation-COVID19-Vaccine-Development-Portfolio.pdf » en annexe
[35] https://www.keionline.org/covid-contracts
[36] https://www.keionline.org/bn-2020-3
https://www.ati.org/
[38] https://www.medcbrn.org/current-members/
[39] https://www.keionline.org/misc-docs/DOD-ATI-Pfizer-Technical-Direction-Letter-OTA-W15QKN-16-9-1002-21July2020.pdf
[40] https://www.cdc.gov/vaccines/covid-19/vaccination-provider-support.html#6-23-22
[41] Le gouvernement néerlandais a révélé une obligation secrète de se conformer aux objectifs de résilience de l'OTAN (article de presse) : https://deanderekrant.nl/kabinet-erkent-navo-is-de-baas/
Œuvre du jour : Chênes de Yountville, aquarelle. Disponible ici .
- Obtenir le lien
- X
- Autres applications






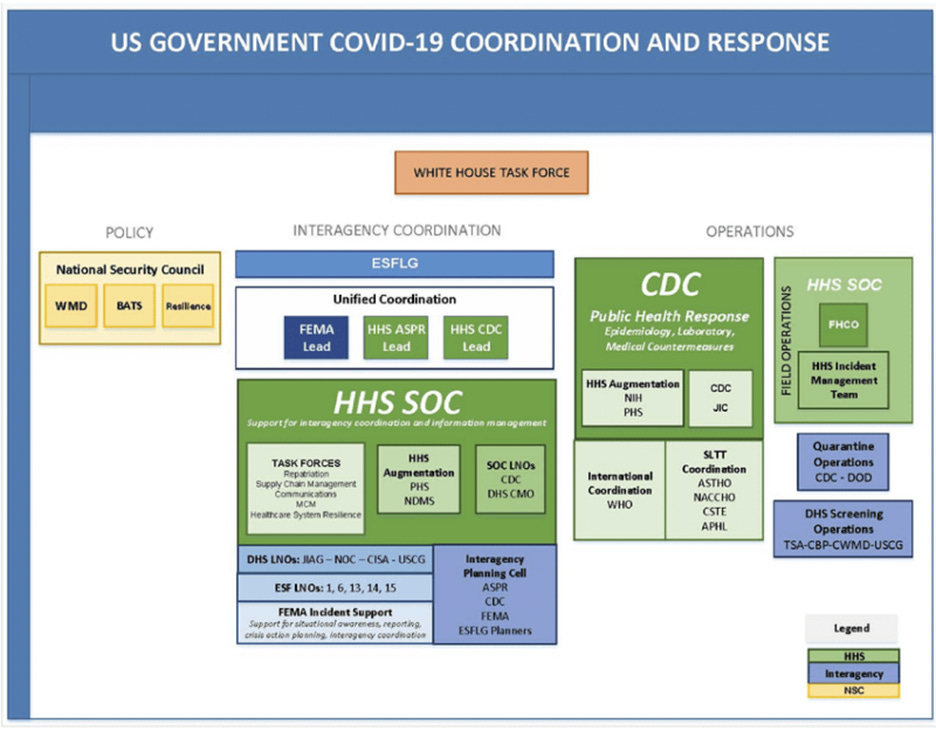
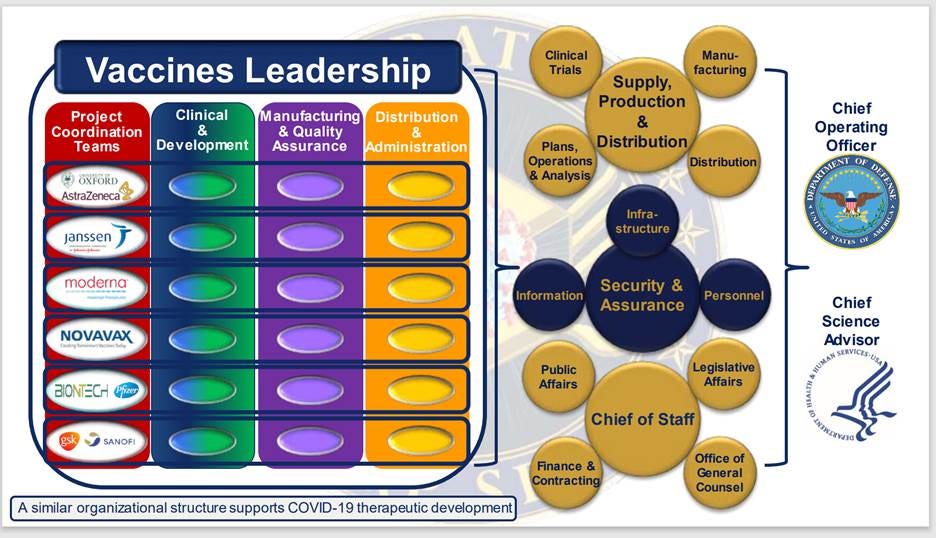


Commentaires
Enregistrer un commentaire