Strontium, aluminium et baryum, oh là là !
- Obtenir le lien
- X
- Autres applications
https://jamesroguski.substack.com/p/strontium-aluminum-and-barium-oh?
Ces éléments sont souvent utilisés dans les feux d'artifice pour produire des explosions rouges, blanches et vertes, ainsi que dans les fusées éclairantes et dans au moins une des expériences de fusées-sondes de la NASA en Norvège.
Que se passerait-il si l'on mélangeait du strontium nanométrique, de l'aluminium nanométrique et du baryum nanométrique ?
Si l'on mélangeait des poudres de strontium, d'aluminium et de baryum à l'échelle nanométrique, on obtiendrait une poudre métallique hautement réactive et mélangée mécaniquement, présentant une instabilité importante : l'énorme surface des nanoparticules les rendrait sujettes à une oxydation rapide à l'air, et le baryum et le strontium — étant des métaux alcalino-terreux fortement électropositifs — réagiraient également vigoureusement avec l'humidité, produisant de la chaleur, de l'hydrogène gazeux et des hydroxydes alcalins.
De plus, ce serait très coloré !
Les principaux effets d'un tel mélange sont une inflammabilité extrême et un risque d'inflammation spontanée (pyrophorie). Les matières pyrophoriques sont des substances, solides, liquides et gazeuses, qui s'enflamment spontanément dans l'air à une température inférieure ou égale à 54 °C en moins de cinq minutes, souvent sans source d'inflammation externe. Elles réagissent violemment avec l'oxygène ou l'humidité de l'air, ce qui exige une manipulation spécialisée, des atmosphères inertes (argon/azote) et des mesures de sécurité rigoureuses pour prévenir les incendies et les explosions.
Le mélange ne formerait pas un composé stable à température ambiante, mais resterait un mélange intime de métaux réactifs susceptibles de s'auto-échauffer dans certaines conditions, de s'enflammer par décharge électrostatique ou frottement, et de présenter un risque sérieux d'explosion de poussières combustibles s'il était dispersé sous forme de nuage. Un tel mélange serait extrêmement dangereux. En l'absence de confinement, il s'oxyderait très probablement lentement avec le temps, tandis que dans des environnements confinés ou propices à l'inflammation, il pourrait brûler intensément et dégager une fumée chaude d'oxyde métallique.
Réactions physiques immédiates
Combustion spontanée (pyrophoricité) :
Les poudres métalliques finement divisées de baryum et d'aluminium peuvent être pyrophoriques, c'est-à-dire qu'elles peuvent s'enflammer spontanément au contact de l'air ou de gaz oxydants. (voir ci-dessus)
Aspects clés des matériaux pyrophoriques :
Définition et comportement : Ces composés s'enflamment instantanément au contact de l'air, produisant souvent de la chaleur et, s'ils réagissent avec l'eau, des gaz inflammables (par exemple, de l'hydrogène).
On prévoit que les nanoparticules d'aluminium naissantes d'un diamètre inférieur à 32 nm seront pyrophoriques.
La poudre de baryum finement divisée est également pyrophorique et peut exploser au contact de l'air.
Réactivité de l'eau :
Le baryum et le strontium sont instables à l'air et réagissent violemment avec l'humidité. Ils décomposent l'eau en libérant de l'hydrogène gazeux, et la chaleur dégagée par cette réaction peut suffire à enflammer ce gaz.
Potentiel explosif :
L'aluminium à l'échelle nanométrique est très sensible à l'oxydation et présente une réactivité bien supérieure à celle de l'aluminium à l'échelle micrométrique. Mélangés, ces matériaux peuvent former des mélanges explosifs au contact de l'air.
Propriétés de détonation améliorées :
Dans les applications industrielles, l'ajout de nano-aluminium aux explosifs ou aux propergols améliore la vitesse de détonation, la chaleur et la pression maximale de l'onde de choc.
Fiches de données de sécurité des matériaux :
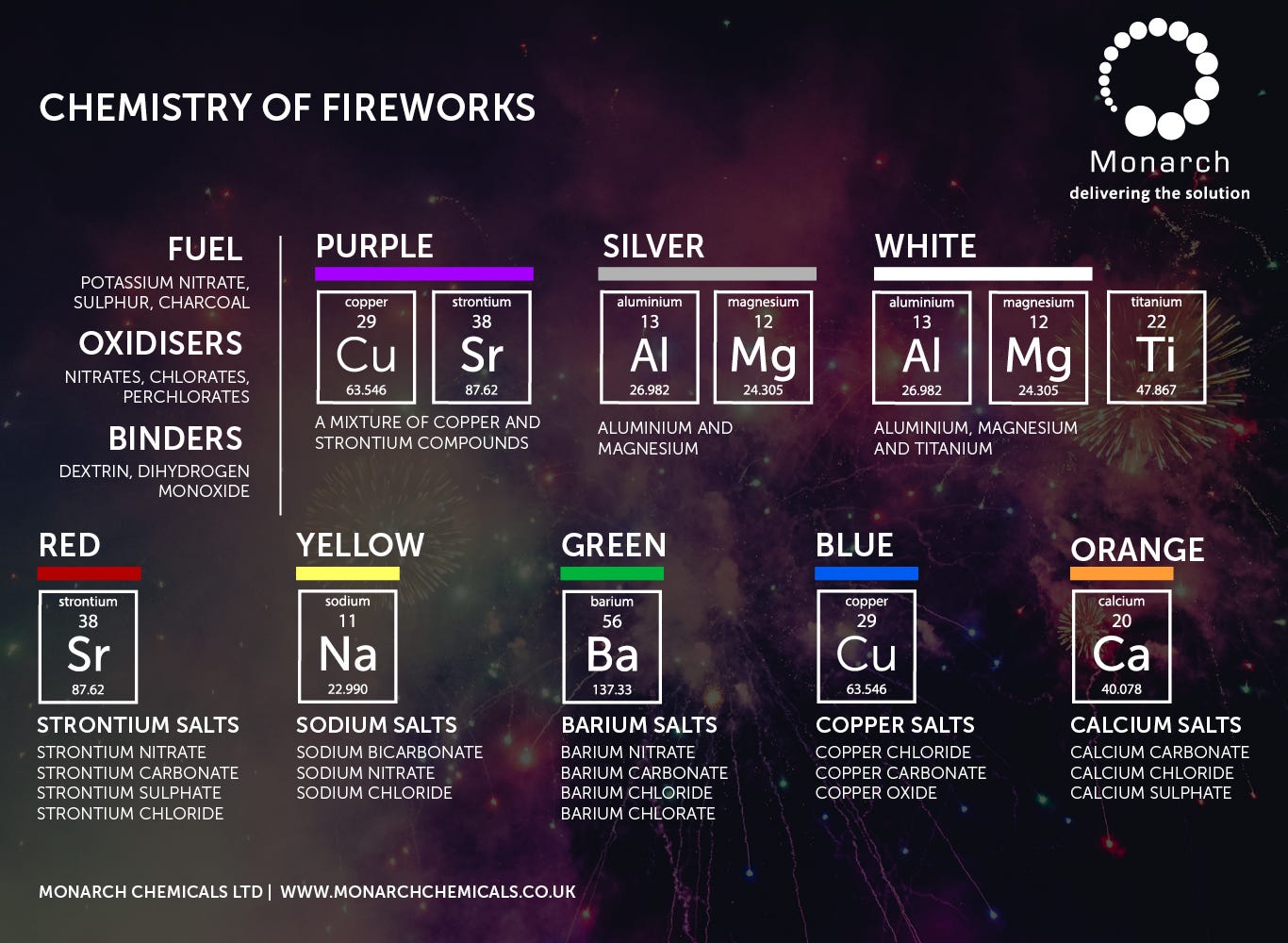
Le strontium, l'aluminium et le baryum sont couramment utilisés dans les feux d'artifice.
SOURCE:
https://skunkbear.tumblr.com/post/90696652324/boom-awww
STRONTIUM
ALUMINIUM
BARYUM
Utilisation mondiale dans les feux d'artifice :
Les estimations ci-dessous sont basées sur une consommation mondiale totale de feux d'artifice estimée entre 700 et 900 millions de livres par an. La Chine produit à elle seule plus de 880 millions de livres (400 000 tonnes) pour les festivals de la région Asie-Pacifique, tandis que les États-Unis en consomment environ 460 millions de livres par an. En se basant sur les tendances de consommation aux États-Unis, les estimations de production mondiale et les formulations pyrotechniques standard, on peut estimer la consommation mondiale annuelle suivante, exprimée en livres :
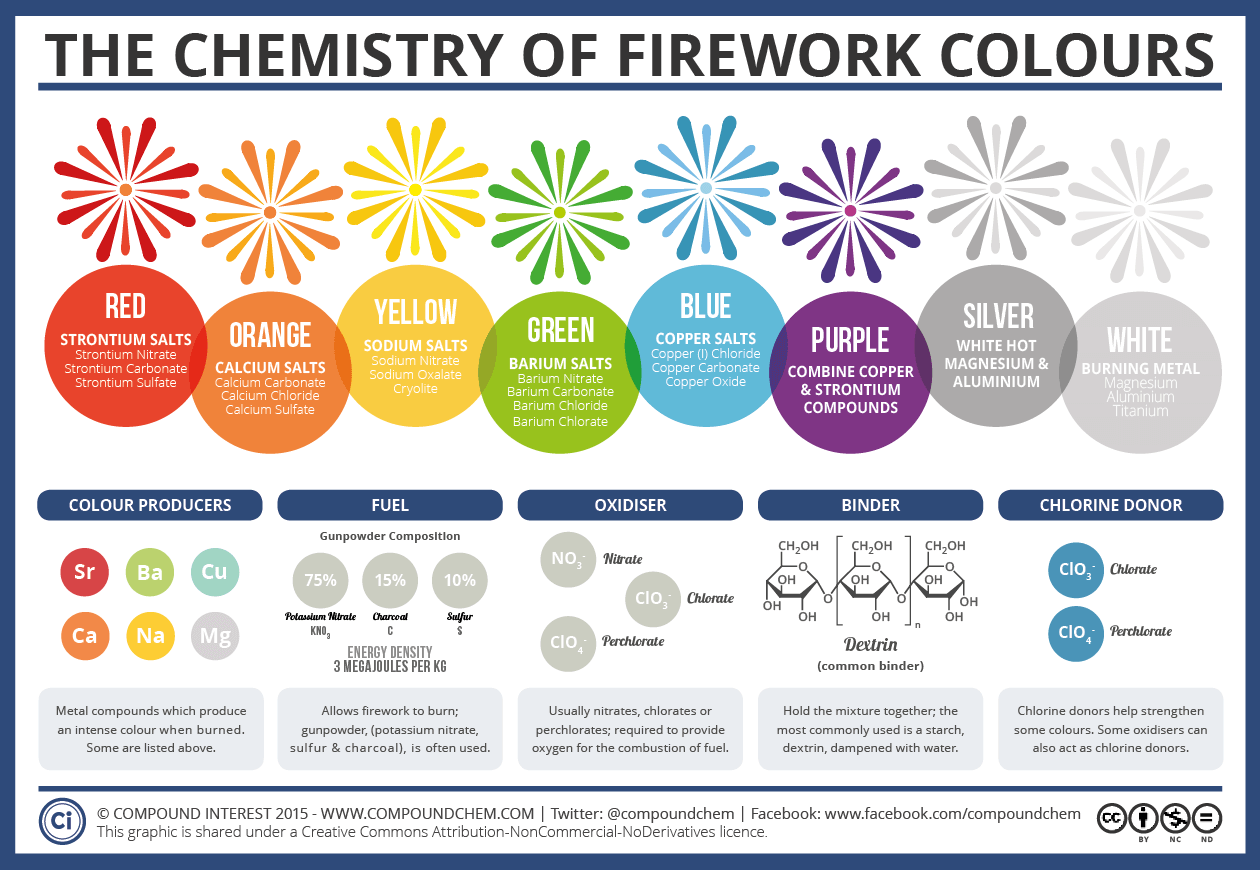
Strontium : 18 à 25 millions de livres . Principalement utilisé sous forme de nitrate ou de carbonate de strontium pour produire des flammes rouges. Bien que les composés de strontium constituent souvent de 20 % à 50 % des étoiles « rouges » spécialisées, ils ne représentent qu’une plus petite fraction de la masse totale des feux d’artifice dans le monde (estimée de 3 % à 5 % pour l’ensemble des produits).
Aluminium : 45 à 60 millions de livres . L’aluminium est le plus utilisé des trois, servant à la fois de combustible et d’élément principal pour les étincelles argentées et les crépitements. Dans un feu d’artifice standard, l’aluminium peut représenter de 5 % à 20 % du poids.
Baryum : 15 à 20 millions de livres . Utilisé pour obtenir la couleur verte, le nitrate de baryum est un composant essentiel des feux d’artifice professionnels. Son utilisation est légèrement moins fréquente que celle du strontium, car le rouge est une couleur plus courante que le vert.
Ces éléments sont essentiels aux feux d'artifice, bien qu'ils soient traditionnellement utilisés sous forme de particules micrométriques ou de sels plutôt que de nanoparticules. La recherche moderne explore cependant de plus en plus les nanoparticules afin de créer des effets plus intenses avec moins de matière.
Comment ils sont utilisés dans les feux d'artifice
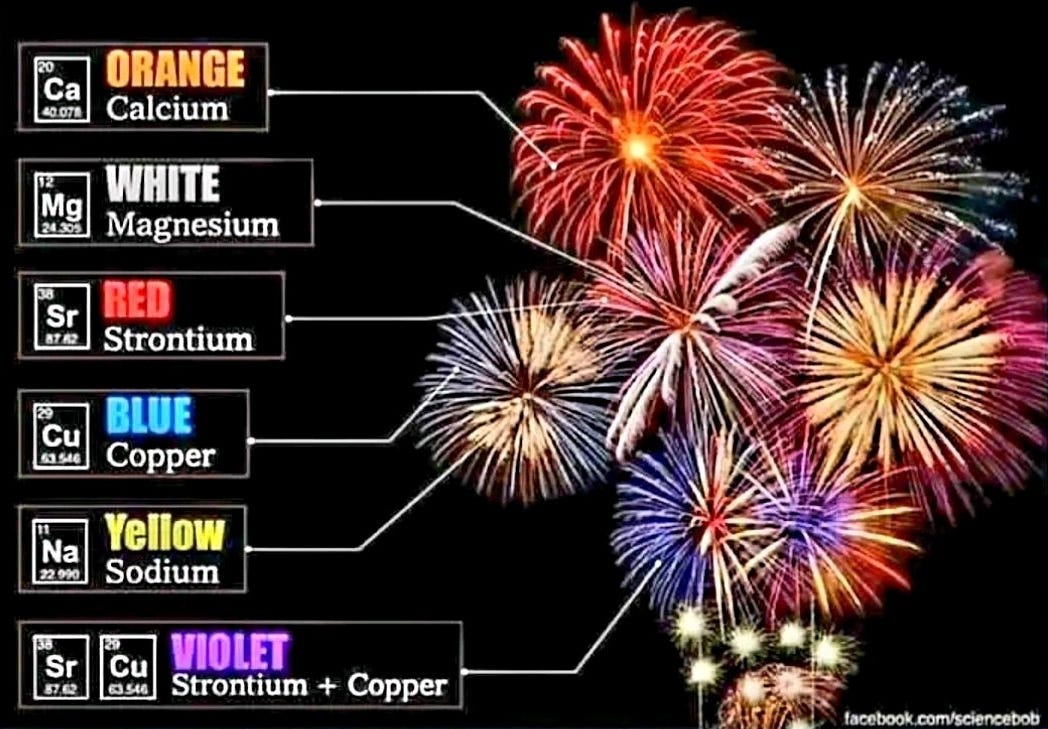
Strontium (couleur rouge) : Les sels de strontium (comme le nitrate de strontium) sont utilisés pour produire des couleurs rouge intense . Il est également mélangé à d’autres éléments pour créer des teintes orangées ou violettes.
Aluminium (Combustible et étincelles) : La poudre d’aluminium est la norme pour produire des étincelles argentées et blanches brillantes ainsi que de fortes détonations. Le nano-aluminium est étudié en particulier pour sa capacité à augmenter significativement la vitesse de combustion et le niveau sonore des pétards par rapport aux micropoudres traditionnelles.
Baryum (couleur verte) : Les composés de baryum (généralement le chlorure de baryum) sont la principale source de couleurs vertes vives .
Nano vs. Formes traditionnelles
Alors que les feux d'artifice traditionnels utilisent des particules plus grosses, l'incorporation de nanoparticules offre plusieurs améliorations en termes de performances :
Intensité accrue : L’utilisation de poudre à l’échelle nanométrique peut produire le même « boom » ou niveau sonore avec seulement 25 % de la matière (par exemple, 1 gramme de nanopoudre équivaut à 4 grammes de micropoudre).
Réaction plus rapide : les particules de taille nanométrique ont une surface beaucoup plus grande, ce qui permet aux réactions chimiques de se produire plus rapidement, conduisant à une inflammation plus rapide et à des explosions plus puissantes.
Impact environnemental : Comme une quantité totale de matière est nécessaire pour un même effet, les feux d'artifice utilisant des nanoparticules peuvent potentiellement réduire la quantité de gaz polluants et de sous-produits métalliques rejetés dans l'air.
Risques pour la sécurité : L’extrême sensibilité du nano-aluminium le rend beaucoup plus dangereux à manipuler ; un simple choc ou frottement peut suffire à l’enflammer prématurément.
Pollution : Même sans utilisation intentionnelle de nanomatériaux, les feux d’artifice libèrent naturellement des nanoparticules métalliques dans l’air, comme sous-produit de la combustion. Des études détectent souvent des concentrations élevées de nanoparticules d’aluminium, de baryum et de strontium dans l’air immédiatement après les grandes festivités.
SOURCE : CLIQUEZ ICI
Je n'ai tout simplement pas pu résister…
Fusées éclairantes au strontium
Le strontium (plus précisément le nitrate de strontium) est le principal composant des fusées éclairantes qui leur confère leur lumière rouge intense caractéristique. Mélangé à des combustibles comme la sciure de bois et le soufre, il sert à la fois de colorant et d'oxydant. Lors de sa combustion, il produit une flamme rouge vif grâce à l'excitation des ions strontium. Il confère la couleur rouge intense et fournit l'oxygène nécessaire à une combustion optimale. Bien que le strontium soit essentiel à la couleur rouge, il entre dans la composition d'autres substances qui peuvent également contenir du perchlorate de potassium, du magnésium et d'autres composés.
Les fusées éclairantes libèrent des composés dangereux, notamment des sels de strontium, qui peuvent provoquer des problèmes de santé au niveau de la peau, des yeux et du système respiratoire.
Bien qu'il n'existe pas de chiffres précis, uniques et actualisés à l'échelle nationale concernant le nombre de fusées éclairantes (fusibles) utilisées chaque année, extraits des statistiques totales sur les fusées éclairantes à usages multiples, les estimations indiquent que des millions d'entre elles sont en circulation et utilisées chaque année pour la sécurité routière.
Dans le seul secteur maritime, on estime qu'il y a entre 30 et 40 millions de torchères en circulation à un moment donné.
Aux États-Unis, environ 350 000 accidents de la route impliquant des véhicules stationnés ou en panne surviennent chaque année. L’utilisation de fusées éclairantes y est largement recommandée. Les équipes d’entretien des routes et les secouristes peuvent utiliser pour environ 60 $ de fusées éclairantes classiques pour intervenir sur un accident d’une durée de 30 minutes.
Du fait de leur courte durée de vie et de leur utilisation fréquente pour la sécurité routière et les interventions d'urgence, le nombre de fusées de signalisation utilisées et jetées chaque année se chiffre probablement en millions.
CLIQUEZ ICI pour en savoir plus sur l'importance du strontium pour la santé osseuse
Expérience de fusée d'upwelling dans la zone aurorale (AZURE)
La NASA a lancé avec succès la mission AZURE (Auroral Zone Upwelling Rocket Experiment) le 5 avril depuis le centre spatial d'Andøya en Norvège.
Deux fusées-sondes Black Brant XI-A ont été lancées à 18h14 et 18h16 EDT le 5 avril, transportant des instruments scientifiques pour étudier l'échange d'énergie au sein d'une aurore boréale.
La mission AZURE vise à mesurer la densité et la température de l'atmosphère grâce à des instruments embarqués sur les fusées et au déploiement de traceurs gazeux visibles : le triméthylaluminium (TMA) et un mélange de baryum et de strontium, qui s'ionise sous l'effet de la lumière solaire. Les vapeurs ont été libérées au-dessus de la mer de Norvège, à une altitude comprise entre 114 et 241 kilomètres.
Ces mélanges, composés de substances similaires à celles utilisées dans les feux d'artifice, ont créé des nuages colorés permettant aux chercheurs de suivre le flux de particules neutres et chargées au gré du vent auroral. En observant le mouvement de ces nuages colorés grâce à la photographie au sol et en triangulant leur position en temps réel dans les trois dimensions, AZURE fournira des données précieuses sur les flux verticaux et horizontaux de particules dans deux régions clés de l'ionosphère, à différentes altitudes.
https://www.nasa.gov/solar-system/nasa-launches-two-rockets-studying-auroras/
Les nuages colorés formés par le dégagement de vapeurs des deux fusées AZURE permettent aux scientifiques de mesurer les vents auroraux. SOURCE : NASA/Lee Wingfield
SOURCE : https://spaceweather.com/images2019/05apr19/2E9A5469.jpeg
Informations Complémentaires:
Le mélange de poudres de strontium (Sr), d'aluminium (Al) et de baryum (Ba) à l'échelle nanométrique crée un mélange métallique hautement réactif et potentiellement pyrophorique . Le comportement de ces particules dépend fortement de l'environnement (air, humidité, confinement, source d'inflammation, proportions et granulométrie). Vous trouverez ci-dessous une analyse détaillée des réactions chimiques et des risques associés.
1. Propriétés individuelles des matériaux
Nano strontium (Sr)
métaux alcalino-terreux
Réagit avec l'air et l'humidité
Brûle avec une flamme rouge
Nano aluminium (Al)
Surface très élevée → s'oxyde rapidement
Brûle intensément une fois allumé.
Combustible commun aux thermites et aux propergols solides pour fusées
Nano baryum (Ba)
Plus réactif que le strontium
Réagit vigoureusement avec l'air et l'eau
Brûle avec une flamme verte
2. En cas de mélange avec l'air (sans source d'inflammation)
Vous verriez probablement :
Oxydation rapide de surface
Auto-échauffement possible
Risque d' inflammation spontanée (surtout si les particules sont très fines et sèches)
Formation progressive de :
Oxyde d'aluminium (Al₂O₃)
Oxyde de strontium (SrO)
Oxyde de baryum (BaO)
Les nanométaux peuvent s'enflammer à des températures bien inférieures à celles des métaux massifs.
3. En cas d'exposition à l'humidité
Le strontium et le baryum réagissent avec l'eau :
Sr + 2H₂O → Sr(OH)₂ + H₂ Ba + 2H₂O → Ba ( OH ) ₂ + H₂ Ba + 2H₂O → Ba ( OH ) ₂ + H₂
Cela produit :
Chaleur
Gaz hydrogène (inflammable)
Hydroxydes alcalins forts
Accumulation d'hydrogène + poudre métallique réactive chaude = risque d'explosion .
4. En cas d'inflammation
Si le mélange était enflammé :
L'aluminium servirait de carburant à haute énergie.
Le strontium et le baryum brûleraient vigoureusement
Le mélange produirait probablement :
températures extrêmement élevées
lumière blanche brillante (provenant d'Al)
Émissions de flamme rouge/verte (Sr/Ba)
fumée d'oxyde métallique
En espace confiné :
→ Déflagration ou explosion
5. Résultat le plus probable
Sans ajout d'oxydant :
Ce ne serait pas un composé stable.
Il resterait un mélange mécanique de métaux réactifs .
Il serait instable, sensible à l'humidité et potentiellement pyrophorique .
6. Principaux dangers
Allumage spontané
Explosion de poussière
production de gaz hydrogène
Brûlures graves
Formation d'hydroxyde caustique
Toxicité du baryum (les composés solubles du baryum sont toxiques)
7. Précision importante
Il n'existe pas d'alliage stable formé par simple mélange de nanopoudres à température ambiante. On obtiendrait un mélange de poudres réactives et dangereuses , et non un nouveau composé chimique.
Un mélange de nano-Al, nano-Sr et nano-Ba présenterait un risque extrêmement élevé d'explosion de poussières et d'emballement thermique . L'échelle nanométrique change la donne, car la surface spécifique et la densité de défauts augmentent considérablement les vitesses de réaction.
1️⃣ Mécanismes d'emballement thermique
L'emballement thermique dans ce système serait provoqué par de multiples voies exothermiques couplées se produisant simultanément.
A. Accélération de l'oxydation de surface
Ces trois métaux s'oxydent à l'air :
4Al+3O2→2Al2O3(ΔH≈−1675 kJ/mol)4 Al +3 O 2→2 Al 2 O 3(Δ H ≈−1675 kJ/mol)2Sr+O2→2SrO2 Sr + O 2→2 SrO 2Ba+O2→2BaO2 Ba + O 2→2 BaO
À l'échelle nanométrique :
Les couches d'oxyde sont plus minces
Les distances de diffusion sont plus courtes
Les défauts augmentent la pénétration de l'oxygène
La chaleur ne peut pas se dissiper efficacement dans les lits de poudre.
Si la production de chaleur est supérieure aux pertes de chaleur → auto-échauffement → inflammation
Il s'agit d'une oxydation auto-accélérée classique .
B. Emballement déclenché par l'humidité
Le strontium et le baryum réagissent fortement avec l'eau :
M + 2H₂O → M ( OH ) ₂ + H₂ + chaleur
Cela crée :
Chaleur
Gaz hydrogène
Hydroxydes fortement alcalins
Accumulation d'hydrogène + surface métallique chaude = voie d'inflammation secondaire.
L'infiltration d'humidité est un facteur de déstabilisation majeur.
C. Effets de micro-couplage galvanique
Dans des nano-mélanges intimes :
Aluminium (plus noble)
Strontium/Baryum (très électropositif)
Les points de micro-contact peuvent créer des piles galvaniques localisées , accélérant la corrosion et le chauffage localisé.
À l'échelle nanométrique, ces jonctions sont nombreuses → cinétique de corrosion améliorée.
D. Boucle de rétroaction hydrogène-métal
Si de l'hydrogène se forme :
Il peut se diffuser dans les réseaux métalliques.
Augmenter la densité des défauts
Favoriser la fissuration des films d'oxyde
exposer du métal neuf
Augmenter le taux d'oxydation
Cela crée une boucle de rétroaction positive .
E. Isolation thermique sur lit de poudre
Poudres fines :
Ont une faible conductivité thermique
Piège à chaleur
Prévenir le refroidissement par convection
Les points chauds se propagent à travers le lit → front de déflagration.
2️⃣ Explosivité des poussières (Kst)
L'explosivité des poussières est quantifiée par :
Kst=(dP/dt)max⋅V1/3 Kst =( dP / dt ) max ⋅ V 1/3
Où:
(dP/dt)max( dP / dt ) max = vitesse maximale d'augmentation de pression
V = volume du vaisseau
Classes de poussière :
St 0 – Non explosif
St 1 – Faible
St 2 – Fort
St 3 – Très fort (extrême)
Données connues (composantes individuelles)
Nano aluminium
Valeurs Kst rapportées :
200 à 1000+ bar·m/s (selon la taille des particules)
Classifié:
St 3 (explosion très forte)
Énergie minimale d'allumage (MIE) :
Extrêmement faible (de l'ordre du millijoule)
Poussière de strontium
Données nano industrielles limitées
Attendu:
Hautement explosif
Probablement St 2–St 3
Seuil d'inflammation très bas
Poussière de baryum
Poussière de métal réactive
Fort potentiel d'explosion
La production d'hydrogène ajoute un risque secondaire
Comportement attendu du mélange
Les effets synergiques augmentent probablement l'explosivité :
Chaleur totale de combustion plus élevée
fenêtre d'allumage plus large
Vitesse de flamme plus rapide
MIE inférieur à celui de l'aluminium seul
Augmentation du taux de montée en pression maximal
Hypothèse prudente :
→ Classification St 3
→ Kst possiblement > aluminium seul (selon la qualité de la dispersion)
3️⃣ Sensibilité à l'allumage
Sources d'inflammation probables :
Décharge statique
Friction
Impact
Étincelle
surface chaude
Accumulation électrostatique
Choc mécanique
Les poudres métalliques nano sont souvent :
En dessous de 10 mJ MIE
Certains en dessous de 1 mJ
À titre de référence :
la décharge électrostatique humaine peut dépasser 20 mJ.
4️⃣ Risque d'explosion secondaire
Événement principal :
Petite inflammation dans un nuage de poussière localisé
Secondaire:
L'onde de choc soulève la poussière déposée
Crée un nuage de poussière plus important
Déflagration massive
C'est fréquent lors d'incidents liés à la poussière métallique.
5️⃣ Amplification toxicologique
Pendant la combustion :
Aérosols d'oxydes métalliques fins
Composés de baryum (toxiques s'ils sont solubles)
Particules d'hydroxyde hautement alcalines
Le risque d'inhalation augmente après une explosion.
6️⃣ Effets du confinement
Ouvert:
Feu éclair
Partiellement confiné :
Déflagration
Confiné:
Explosion
rupture structurelle due à la surpression
Les nanopoudres brûlent plus vite → dP/dt plus élevé.
7️⃣ Classification réglementaire
Cela relèverait probablement de :
Poussières de métaux combustibles (NFPA 484)
Classe de danger 4.3 (solides réactifs à l'eau)
Classification possible des matériaux pyrophoriques
8️⃣ Profil de risque global
Ce mélange serait probablement :
Extrêmement sensible à l'allumage
Très explosif dans un nuage dispersé
Capable de s'auto-échauffer
Fortement réactif à l'eau
Capable d'emballement thermique en stockage
Risque d'explosion secondaire grave
James Roguski
310-619-3055
Mon histoire
JamesRoguski.substack.com/archive
Tout soutien est grandement apprécié.
- Obtenir le lien
- X
- Autres applications






















Commentaires
Enregistrer un commentaire